某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。为防止Fe2+被氧化,FeCl2溶液中需加入___________ 反应的化学方程式为___________ 。
(2)甲组同学取2 mL FeCl2溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明___________ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是___________ 。
(4)丙组同学取5 mL 0.1 mol/LKI溶液,加入6 mL 0.1 mol/LFeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1滴淀粉溶液,溶液显___________ 色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子可能是___________ (填离子符号);写出KI与FeCl3反应的离子方程式___________ 。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。为防止Fe2+被氧化,FeCl2溶液中需加入
(2)甲组同学取2 mL FeCl2溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是
(4)丙组同学取5 mL 0.1 mol/LKI溶液,加入6 mL 0.1 mol/LFeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1滴淀粉溶液,溶液显
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子可能是
21-22高一上·浙江·阶段练习 查看更多[3]
更新时间:2021-04-28 23:01:54
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】氢氧化亚铁易被氧化,制取过程要隔绝空气。现用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁并观察其颜色,改进装置如下:
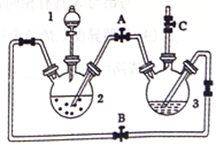
(1)稀硫酸应放在_____________ (填写仪器名称)中。
(2)本实验通过关闭开关________ 、打开开关_________ ,将仪器中的空气排尽后,后续实验就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由___________________ 。
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___________
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
滴定过程中发生反应的离子方程式为______________ 。滴定终点的现象是__________________________ 。通过实验数据计算的该产品纯度为_____________ (用字母a、b表示)。

(1)稀硫酸应放在
(2)本实验通过关闭开关
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗酸性高锰酸钾溶液体积/mL | 20.02 | 19.98 | 20.52 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某化学兴趣小组探究铁粉与硫酸铜溶液反应时溶液pH变化。
Ⅰ.回答下列问题:
(1)甲同学提出硫酸铜溶液显酸性,理由是___________ (写离子方程式) ,加入铁粉消耗了Cu2+和H+,溶液pH会___________ (填“增大” 、“不变”或“减小”;已知相同条件下,Cu2+的水解程度强于Fe2+)。
Ⅱ.乙同学用pH传感器测铁粉和0. 25 mol/L CuSO4溶液反应时溶液pH的变化。
【实验用品】
仪器:pH传感器、笔记本电脑、带橡皮塞的250 mL三颈烧瓶铁架台、分液漏斗等。
试剂:4.2g铁粉、0.25 mol/L CuSO4溶液。
【实验步骤】向三颈烧瓶中加入4.2 g铁粉,将0. 25 mol L-1 CuSO4溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
L-1 CuSO4溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。

(2)乙同学猜想反应过程中pH下降与亚铁离子和溶液中氧气反应有关,理由是___________ (写离子方程式;常温下,Fe3+在pH=3.2时完全沉淀),验证反应后的溶液中不存在Fe3+的方法是___________ 。
(3)为了验证猜想,乙同学用煮沸后冷却的蒸馏水新配制0.25 mol/LCuSO4溶液,重新进行实验。
①配制0.25 mol/LCuSO4溶液所用的蒸馏水需提前煮沸、冷却的目的是___________ ,配制250 mL0.25 mol/LCuSO4溶液需要称量___________ (保留小数点后一位)gCuSO4·5H2O。
②下列实验操作会使所配制的溶液浓度偏高的是___________ (填标号)。
a.所称量的CuSO4·5H2O失去部分结晶水
b.容量瓶洗净后刻度线下残留少量水未处理
c.移液后未洗涤烧杯和玻璃棒
d未用0.25 mol/L CuSO4溶液润洗容量瓶
③改进之后测得溶液pH的变化趋势为___________ ,证明乙同学的猜想正确(忽略容器内空气对实验的影响)。
Ⅰ.回答下列问题:
(1)甲同学提出硫酸铜溶液显酸性,理由是
Ⅱ.乙同学用pH传感器测铁粉和0. 25 mol/L CuSO4溶液反应时溶液pH的变化。
【实验用品】
仪器:pH传感器、笔记本电脑、带橡皮塞的250 mL三颈烧瓶铁架台、分液漏斗等。
试剂:4.2g铁粉、0.25 mol/L CuSO4溶液。
【实验步骤】向三颈烧瓶中加入4.2 g铁粉,将0. 25 mol
 L-1 CuSO4溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
L-1 CuSO4溶液滴入铁粉中,同时插入pH传感器检测溶液pH的变化,实验装置(夹持装置已省略)及测得的pH变化曲线如图所示。
(2)乙同学猜想反应过程中pH下降与亚铁离子和溶液中氧气反应有关,理由是
(3)为了验证猜想,乙同学用煮沸后冷却的蒸馏水新配制0.25 mol/LCuSO4溶液,重新进行实验。
①配制0.25 mol/LCuSO4溶液所用的蒸馏水需提前煮沸、冷却的目的是
②下列实验操作会使所配制的溶液浓度偏高的是
a.所称量的CuSO4·5H2O失去部分结晶水
b.容量瓶洗净后刻度线下残留少量水未处理
c.移液后未洗涤烧杯和玻璃棒
d未用0.25 mol/L CuSO4溶液润洗容量瓶
③改进之后测得溶液pH的变化趋势为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题
I.硫酸亚铁是一种重要的工业原料,同时也可以用于制造补血药物,但其具有毒性,故严禁在食品中滥用硫酸亚铁,请回答下列问题:
(1)下列说法中正确的是___________(填字母)。
Ⅱ.某同学为探究富含硫酸亚铁且保存时间较长的糕点情况,设计了如下实验方案:

(2)试剂1的化学式是___________ 。
(3)加入新制氯水后,溶液红色加深的原因是___________ (用离子方程式表示)
(4)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①[提出假设]假设1:溶液中的+3价铁被氧化为更高的价态。假设2:___________ 。
②[设计方案]为了对假设2进行验证,简述你的设计方案:___________ 。
(5)FeSO4固体应___________ 保存。
(6)将铜片放入0.1 mol/LFeCl3溶液中,反应一段时间后,取出铜片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为___________ 。
I.硫酸亚铁是一种重要的工业原料,同时也可以用于制造补血药物,但其具有毒性,故严禁在食品中滥用硫酸亚铁,请回答下列问题:
(1)下列说法中正确的是___________(填字母)。
| A.可以使用明矾作糕点膨化剂 |
| B.大量服用FeSO4导致人体中毒可能与其还原性有关 |
| C.向FeSO4溶液中加入铜粉可析出铁单质 |
| D.向FeSO4溶液中加入少许铁粉,其目的是防止Fe2+被还原 |
Ⅱ.某同学为探究富含硫酸亚铁且保存时间较长的糕点情况,设计了如下实验方案:

(2)试剂1的化学式是
(3)加入新制氯水后,溶液红色加深的原因是
(4)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①[提出假设]假设1:溶液中的+3价铁被氧化为更高的价态。假设2:
②[设计方案]为了对假设2进行验证,简述你的设计方案:
(5)FeSO4固体应
(6)将铜片放入0.1 mol/LFeCl3溶液中,反应一段时间后,取出铜片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下列物质转化关系如图所示,反应过程中部分产物可能已略去。

请回答以下问题:
(1)E溶液中溶质的化学式为___________ 。若将沉淀C加热至恒重,最终得到的物质是_____________ 。
(2)A溶液中滴加入NaOH溶液,振荡,放置一段时间,可以观察到的现象是_________ ,发生反应的化学方程式有_____________________ 。
(3)若在酸性的A溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式__________ 。

请回答以下问题:
(1)E溶液中溶质的化学式为
(2)A溶液中滴加入NaOH溶液,振荡,放置一段时间,可以观察到的现象是
(3)若在酸性的A溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某工厂排放的污水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,需要回收污水中的铜和汞,并得到绿矾。设计如下方案:
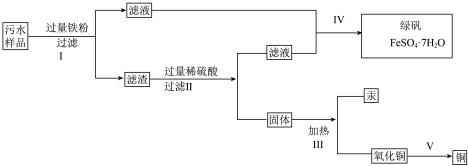
(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等。为完成步骤Ⅳ的实验操作,还需要选择下列仪器________ (填字母)。设计简单实验检验绿矾是否变质:__________________________________________________ 。
(2)步骤Ⅰ加入过量的铁粉的目的是__________________________________ ,
步骤Ⅱ能否用盐酸代替硫酸?________ (填“能”或“否”)。
(3)步骤Ⅲ的实验装置如图所示,加热装置应与________ 装置连接,理由是______ 。
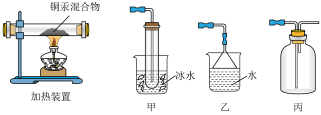
(4)利用氧化铜制铜,设计如下四种方案:
甲方案:利用氢气还原氧化铜;
乙方案:利用一氧化碳还原氧化铜;
丙方案:利用炭粉还原氧化铜;
丁方案:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。
从安全角度考虑,方案________ 不好;从产品纯度考虑方案________ 不好(填“甲”、“乙”、“丙”或“丁”)。
(5)步骤Ⅰ中涉及的离子反应有____________________________________________________
(6)收集汞时,不小心将少量汞洒在地上,正确的处理方法是__________________________________________________________

(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等。为完成步骤Ⅳ的实验操作,还需要选择下列仪器
(2)步骤Ⅰ加入过量的铁粉的目的是
步骤Ⅱ能否用盐酸代替硫酸?
(3)步骤Ⅲ的实验装置如图所示,加热装置应与

(4)利用氧化铜制铜,设计如下四种方案:
甲方案:利用氢气还原氧化铜;
乙方案:利用一氧化碳还原氧化铜;
丙方案:利用炭粉还原氧化铜;
丁方案:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。
从安全角度考虑,方案
(5)步骤Ⅰ中涉及的离子反应有
(6)收集汞时,不小心将少量汞洒在地上,正确的处理方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某化学研究性学习小组讨论 和
和 之间会发生怎样的反应,提出了两种可能:一是发生氧化还原反应
之间会发生怎样的反应,提出了两种可能:一是发生氧化还原反应 ;二是发生相互促进的水解反应
;二是发生相互促进的水解反应 。为了证明发生的是哪一种反应,同学们设计并实施了以下实验,请填写下列空白。
。为了证明发生的是哪一种反应,同学们设计并实施了以下实验,请填写下列空白。
实验Ⅰ 学生选择的实验用品有 浓溶液、
浓溶液、 稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,设计这个实验的目的是
稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,设计这个实验的目的是___________ 。
实验Ⅱ 取 浓溶液于试管中,逐滴加入
浓溶液于试管中,逐滴加入 浓溶液,观察到溶液由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入
浓溶液,观察到溶液由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入 浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是
浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是__________ 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是__________ 。将溶液分成两等份,其中一份加入 溶液,溶液变成血红色,反应的离子方程式为
溶液,溶液变成血红色,反应的离子方程式为_______ ;另一份加入 稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式为
稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式为______ 。
实验Ⅲ 换用稀释的 溶液和
溶液和 溶液重复实验Ⅱ,产生的现象完全相同。由上述实验得出的结论是
溶液重复实验Ⅱ,产生的现象完全相同。由上述实验得出的结论是________ 。若在 浓溶液中加入
浓溶液中加入 浓溶液,观察到有红褐色沉淀生成并且产生无色气体,该反应的离子方程式是
浓溶液,观察到有红褐色沉淀生成并且产生无色气体,该反应的离子方程式是_______ 。从形式上看, 和
和 相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其原因可能是①
相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其原因可能是①________ ;②________ 。
 和
和 之间会发生怎样的反应,提出了两种可能:一是发生氧化还原反应
之间会发生怎样的反应,提出了两种可能:一是发生氧化还原反应 ;二是发生相互促进的水解反应
;二是发生相互促进的水解反应 。为了证明发生的是哪一种反应,同学们设计并实施了以下实验,请填写下列空白。
。为了证明发生的是哪一种反应,同学们设计并实施了以下实验,请填写下列空白。实验Ⅰ 学生选择的实验用品有
 浓溶液、
浓溶液、 稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,设计这个实验的目的是
稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,设计这个实验的目的是实验Ⅱ 取
 浓溶液于试管中,逐滴加入
浓溶液于试管中,逐滴加入 浓溶液,观察到溶液由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入
浓溶液,观察到溶液由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入 浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是
浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 溶液,溶液变成血红色,反应的离子方程式为
溶液,溶液变成血红色,反应的离子方程式为 稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式为
稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式为实验Ⅲ 换用稀释的
 溶液和
溶液和 溶液重复实验Ⅱ,产生的现象完全相同。由上述实验得出的结论是
溶液重复实验Ⅱ,产生的现象完全相同。由上述实验得出的结论是 浓溶液中加入
浓溶液中加入 浓溶液,观察到有红褐色沉淀生成并且产生无色气体,该反应的离子方程式是
浓溶液,观察到有红褐色沉淀生成并且产生无色气体,该反应的离子方程式是 和
和 相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其原因可能是①
相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其原因可能是①
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】在学习氧化还原反应时,甲同学提出Ag+具有较强氧化性,可以氧化具有还原性的物质。为验证这个问题,甲同学设计了如下实验。
(1)研究AgNO3溶液与KI溶液反应产物
向盛有1mL1mol/LAgNO3溶液的试管中加入1mL1mol/LKI溶液,振荡试管,向其中加入_______ ,溶液无明显变化。(提示:若发生氧化还原反应,I-应被氧化为单质)
(实验结论)二者混合只发生沉淀反应,无明显氧化还原反应。
(2)研究AgNO3溶液与铁反应产物
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:①KSCN溶液②NaOH溶液③酸性KMnO4溶液。请完成表格:
(实验结论)铁的氧化产物为Fe2+和Fe3+,则Ag+氧化性强于Fe3+。
乙同学用pH计测得常温该硝酸银溶液的pH为5.50,于是乙同学对甲同学的实验结论提出质疑。你认为乙同学提出质疑的理由可能是_______ 。
(1)研究AgNO3溶液与KI溶液反应产物
向盛有1mL1mol/LAgNO3溶液的试管中加入1mL1mol/LKI溶液,振荡试管,向其中加入
(实验结论)二者混合只发生沉淀反应,无明显氧化还原反应。
(2)研究AgNO3溶液与铁反应产物
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:①KSCN溶液②NaOH溶液③酸性KMnO4溶液。请完成表格:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 存在Fe3+ | |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴 | 存在Fe2+ |
乙同学用pH计测得常温该硝酸银溶液的pH为5.50,于是乙同学对甲同学的实验结论提出质疑。你认为乙同学提出质疑的理由可能是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】实验室以锈蚀程度很大的废铁屑为原料制备FeCl3?6H2O晶体的流程可简要表示如图:

已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生主要反应有:①Fe+2H+=Fe2++H2↑;②Fe2O3+6H+=2Fe3++3H2O;③_______ 。
(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液后的现象是_______ 。
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是_______ ,为控制该温度可以采用的加热方式为_______ 。
(4)“氧化”过程可在如图所示装置中进行。
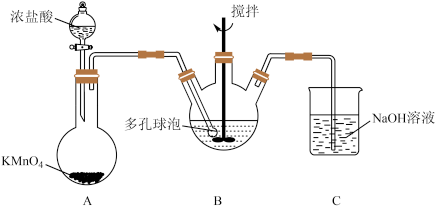
①装置A中KMnO4与浓盐酸反应生成了Cl2,其离子方程式为_______ 。
②B中使用多孔球泡的作用是_______ 。
③证明装置B溶液中Fe2+已完全被氧化成Fe3+的实验方案是_______ 。

已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生主要反应有:①Fe+2H+=Fe2++H2↑;②Fe2O3+6H+=2Fe3++3H2O;③
(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液后的现象是
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是
(4)“氧化”过程可在如图所示装置中进行。

①装置A中KMnO4与浓盐酸反应生成了Cl2,其离子方程式为
②B中使用多孔球泡的作用是
③证明装置B溶液中Fe2+已完全被氧化成Fe3+的实验方案是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是___________ 。
(2)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为___________ 。
(3)能说明氧化性Fe3+>SO2的离子方程式是___________ 。
(4)完成上述实验后,①若经检验,过程ⅣB溶液中有Fe3+无Fe2+,过程ⅥB溶液中含___________ 离子,即能够证明氧化性Cl2>Fe3+>SO2.检验该离子的试剂为___________ (填化学式,下同)。②若经检验,过程ⅣB溶液中既有Fe3+又有Fe2+,过程ⅥB溶液中含___________ 离子,即能够证明氧化性Cl2>Fe3+>SO2.检验该离子的试剂为___________ 。

实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是
(2)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为
(3)能说明氧化性Fe3+>SO2的离子方程式是
(4)完成上述实验后,①若经检验,过程ⅣB溶液中有Fe3+无Fe2+,过程ⅥB溶液中含
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4 b.含有FeSO4和Fe2(SO4)3 c.只含有Fe2(SO4)3
将化肥固体粉末溶于水得到溶液(记为X),进行如下实验:
(1)实验ⅰ中加入的1mL1mol·L-1NaOH溶液中含有NaOH___ g。
(2)对实验ⅰ的预期现象是产生白色沉淀、变为灰绿色、最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式表示)___ 、___ 。
(3)实验ⅱ现象说明假设___ 不成立。
为进一步验证假设,小组同学进行了以下实验:
(4)实验ⅳ中,KMnO4 是该反应的___ (填“氧化剂”或“还原剂”)。
(5)通过以上实验,可得到的结论是____ 。
a.只含有FeSO4 b.含有FeSO4和Fe2(SO4)3 c.只含有Fe2(SO4)3
将化肥固体粉末溶于水得到溶液(记为X),进行如下实验:
| 序号 | 操作 | 现象 |
| ⅰ | 取2mL溶液X,加入1mL1mol·L-1NaOH溶液 | 产生红褐色沉淀 |
| ⅱ | 取2mL溶液X,加入1滴KSCN溶液 | 溶液显红色 |
(1)实验ⅰ中加入的1mL1mol·L-1NaOH溶液中含有NaOH
(2)对实验ⅰ的预期现象是产生白色沉淀、变为灰绿色、最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式表示)
(3)实验ⅱ现象说明假设
为进一步验证假设,小组同学进行了以下实验:
| 序号 | 操作 | 现象 |
| ⅲ | 取2mL溶液X,加入1滴KSCN溶液,再加入1mL水 | 溶液显红色 |
| ⅳ | 取2mL溶液X,滴入1滴酸性KMnO4溶液 | KMnO4溶液紫红色褪去 |
(4)实验ⅳ中,KMnO4 是该反应的
(5)通过以上实验,可得到的结论是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如图:

请回答下列问题:
(1)证明经步骤①得到的滤液中含有Fe2+的方法如下:取样,先滴加___ ,再滴加少量氯水,该过程的现象为___ 。
(2)证明步骤①得到的滤液中含有SO 的方法:
的方法:___ 。
(3)步骤②加入H2O2发生反应的离子方程式是___ 。
(4)步骤④中一系列操作为___ 、洗涤、灼烧、冷却、称量。任写一种该红棕色固体的用途___ 。
(5)若实验中铁元素无损耗,则每片补血剂含铁元素的质量为___ g。

请回答下列问题:
(1)证明经步骤①得到的滤液中含有Fe2+的方法如下:取样,先滴加
(2)证明步骤①得到的滤液中含有SO
 的方法:
的方法:(3)步骤②加入H2O2发生反应的离子方程式是
(4)步骤④中一系列操作为
(5)若实验中铁元素无损耗,则每片补血剂含铁元素的质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某研究小组欲探究 能否与
能否与 溶液反应。
溶液反应。
【查阅资料】
i. 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。
ii. 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。
【提出猜想】
(1)小组同学经过讨论后,认为 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:___________ 。
【设计实验】
(2)实验I:在试管中加入 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液_____ ,小组同学认为 和
和 溶液反应生成了
溶液反应生成了 。
。
(3)甲同学注意到盛放 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是______ 。
重新设计实验:
实验II:在试管中加入 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。
【获得结论】
(4)过氧化氢___________ (填“能”或者“不能”)氧化 。
。
【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。
(5)补全实验III的方案:在试管中加入 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入___________ ,产生___________ 。
【总结反思】
(6)小组同学经过讨论后,提出了 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中,___________ ,证明待测液含有 。
。
(7)从上述实验中可以得出结论,在物质性质的检验中,应注意___________ (至少写出两条)对实验结果的影响。
 能否与
能否与 溶液反应。
溶液反应。【查阅资料】
i.
 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。ii.
 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。【提出猜想】
(1)小组同学经过讨论后,认为
 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:【设计实验】
(2)实验I:在试管中加入
 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液 和
和 溶液反应生成了
溶液反应生成了 。
。(3)甲同学注意到盛放
 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是重新设计实验:
实验II:在试管中加入
 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。【获得结论】
(4)过氧化氢
 。
。【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将
 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。(5)补全实验III的方案:在试管中加入
 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入【总结反思】
(6)小组同学经过讨论后,提出了
 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中, 。
。(7)从上述实验中可以得出结论,在物质性质的检验中,应注意
您最近一年使用:0次



