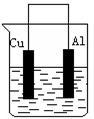
现有如下两个反应:A、NaOH+HCl=NaCl+H2O B、Cu+2Ag+=2Ag+Cu2+
(1)根据两反应本质,判断___________ 能设计成原电池。
(2)如果不能,说明其原因___________ 。
(3)如果可以,请选择正、负极材料(可供选择:铜片、锌片、石墨棒)、写出其电极反应式、反应类型(“氧化”或“还原”):
负极:___________ ,___________ ,___________ 反应。
正极:___________ ,___________ ,___________ 反应。
电解质溶液为___________ (填化学式),若导线上转移电子0.1 mol,则正极质量增加___________ g。
(1)根据两反应本质,判断
(2)如果不能,说明其原因
(3)如果可以,请选择正、负极材料(可供选择:铜片、锌片、石墨棒)、写出其电极反应式、反应类型(“氧化”或“还原”):
负极:
正极:
电解质溶液为
更新时间:2021/05/11 14:29:16
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,回答下列问题。
(1)铅蓄电池在放电时发生的总反应为 ,负极电极反应式为
,负极电极反应式为_______ 。工作后,铅蓄电池里电解质溶液的pH_______ (填“变大”“变小”或“不变”)。
(2)FeCl3溶液常用于腐蚀印刷电路板,发生反应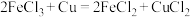 ,若将此反应设计成原电池,则负极所用电极材料为
,若将此反应设计成原电池,则负极所用电极材料为_______ 。当转移0.2mol电子时,被腐蚀的铜的质量为_______ g。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_______ 。
A铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)燃料电池是一种高效、环境友好的供电装置。
①如图是电解质溶液为稀硫酸的氢氧燃料电池原理示意图:_______ 。
②将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入甲烷气体的一极是原电池的_______ 极,该极的电极反应式是_______ 。
(1)铅蓄电池在放电时发生的总反应为
 ,负极电极反应式为
,负极电极反应式为(2)FeCl3溶液常用于腐蚀印刷电路板,发生反应
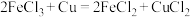 ,若将此反应设计成原电池,则负极所用电极材料为
,若将此反应设计成原电池,则负极所用电极材料为(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)燃料电池是一种高效、环境友好的供电装置。
①如图是电解质溶液为稀硫酸的氢氧燃料电池原理示意图:
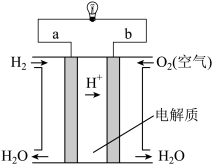
②将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入甲烷气体的一极是原电池的
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】利用原电池原理设计各类电池,以满足不同的需要。请回答下列问题:
(1)用Mg、A1与设计氢氧化钠溶液设计原电池,负极的电极反应为_______ 。
(2)用反应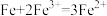 设计原电池,正极的电极材料为
设计原电池,正极的电极材料为_______ 。
(3)如图为甲烷燃料电池原理示意图。

甲烷通入的一极为电源的_______ 极(填“正”或“负”),该电极反应式:_______ ,当电路中累计有2mol电子通过时,消耗的氧气体积为_______ (在标准状况下)L。
(4)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如下图所示。电池反应为 。
。

写出该电池的负极电极反应式_______ 。
(1)用Mg、A1与设计氢氧化钠溶液设计原电池,负极的电极反应为
(2)用反应
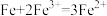 设计原电池,正极的电极材料为
设计原电池,正极的电极材料为(3)如图为甲烷燃料电池原理示意图。

甲烷通入的一极为电源的
(4)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如下图所示。电池反应为
 。
。
写出该电池的负极电极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】图为某化学兴趣小组探究不同条件下化学能转变为电能的装置。根据原电池原理回答问题:
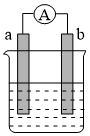
(1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置工作时,Cu电极上的可以看到的现象___ ,SO 向
向____ 极(填a或b)移动,正极的电极反应式为___ 。
(2)若电极a为Fe、电极b为Ag、电解质溶液为硝酸银,该原电池工作时,原电池的负极材料为___ ,电子沿导线向___ (填a/b)移动。
(3)FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu=2FeCl2+CuCl2)请将此反应设计成原电池,该原电池负极的电极材料为___ ,正极的电极材料为____ ,电解质溶液为___ ,负极的电极反应式为___ 。

(1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置工作时,Cu电极上的可以看到的现象
 向
向(2)若电极a为Fe、电极b为Ag、电解质溶液为硝酸银,该原电池工作时,原电池的负极材料为
(3)FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu=2FeCl2+CuCl2)请将此反应设计成原电池,该原电池负极的电极材料为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】①已知反应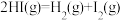 的
的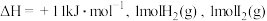 分子中化学键断裂时分别需要吸收
分子中化学键断裂时分别需要吸收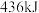 、
、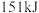 的能量,则
的能量,则 分子中化学键断裂时需吸收的能量为
分子中化学键断裂时需吸收的能量为____  。
。
②氢气与氧气反应生成 液态水,放出热量
液态水,放出热量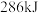 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:__________ 。
(2)①火箭发射常用肼 为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知: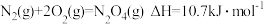
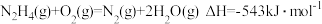
写出气态肼和四氧化二氮气体反应的热化学方程式为____ 。
②肼( )—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的
)—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的 溶液。该电池放电时,负极的电极反应式是
溶液。该电池放电时,负极的电极反应式是_______ 。
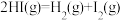 的
的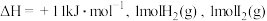 分子中化学键断裂时分别需要吸收
分子中化学键断裂时分别需要吸收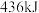 、
、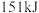 的能量,则
的能量,则 分子中化学键断裂时需吸收的能量为
分子中化学键断裂时需吸收的能量为 。
。②氢气与氧气反应生成
 液态水,放出热量
液态水,放出热量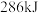 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:(2)①火箭发射常用肼
 为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。已知:
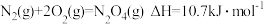
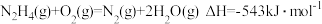
写出气态肼和四氧化二氮气体反应的热化学方程式为
②肼(
 )—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的
)—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的 溶液。该电池放电时,负极的电极反应式是
溶液。该电池放电时,负极的电极反应式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)科学工作者为心脏病人设计的心脏起搏器使用的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧和H+进行工作。回答下列问题:
①正极材料是:___________ ,正极反应为:_______________
②负极材料是:___________ ,负极反应为:_________________
(2)写出下列反应的化学方程式:
①在催化剂条件下苯与液溴发生反应:_________________________________
②乳酸( )与金属钠反应:
)与金属钠反应:___________________________
①正极材料是:
②负极材料是:
(2)写出下列反应的化学方程式:
①在催化剂条件下苯与液溴发生反应:
②乳酸(
 )与金属钠反应:
)与金属钠反应:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】电化学应用广泛。请回答下列问题:
(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为_________ ;正极的电极反应式为__________________ 。
(2)燃料电池和二次电池的应用非常广泛。
①如图为甲烷燃料电池的示意图,电池工作时,b极的电极名称为_______ ;负极的电极反应式为____________ ;
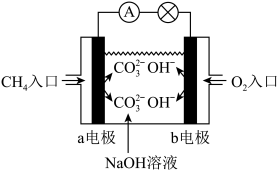
②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2 + Pb+ 2H2SO4 === PbSO4 + 2H2O,铅蓄电池负极的电极反应式为__________ ;充电时,铅蓄电池的PbO2极应与外加直流电源的__ 极相连,PbO2极的电极反应式为_________ 。
(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应质)时,以硫酸铜溶液为电解质溶液,粗铜做_____ 极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为________ 。
(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为
(2)燃料电池和二次电池的应用非常广泛。
①如图为甲烷燃料电池的示意图,电池工作时,b极的电极名称为

②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2 + Pb+ 2H2SO4 === PbSO4 + 2H2O,铅蓄电池负极的电极反应式为
(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应质)时,以硫酸铜溶液为电解质溶液,粗铜做
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】本题分为选做题(a)、(b)两道平行题,分值一样,可根据高一课程学习情况选择其中一道题完成作答,若二道题均作答,则按(a)题给分。
(a)有H、N、O、Na、Cl五种短周期主族元素。
(1)写出氯离子的原子结构示意图________ ,写出水分子的电子式________ 。
(2)NH4NO3是_______ 化合物(填“离子”或“共价”)。
(3)氯气是有毒气体,写出用饱和氢氧化钠溶液吸收氯气的离子方程式:_____________ 。
(4)金属元素铁是中学化学常见元素,将铁单质浸入氯化铁溶液中,该反应的离子方程式为__________ 。
(5)请依据(4)中的反应,设计一个原电池。要求:画出实验装置图,注明电解质溶液名称、正负极及正负极材料,并标出电子移动方向,写出电极反应式。

正极反应式:___________________ ,负极反应式:___________________ 。
(a)有H、N、O、Na、Cl五种短周期主族元素。
(1)写出氯离子的原子结构示意图
(2)NH4NO3是
(3)氯气是有毒气体,写出用饱和氢氧化钠溶液吸收氯气的离子方程式:
(4)金属元素铁是中学化学常见元素,将铁单质浸入氯化铁溶液中,该反应的离子方程式为
(5)请依据(4)中的反应,设计一个原电池。要求:画出实验装置图,注明电解质溶液名称、正负极及正负极材料,并标出电子移动方向,写出电极反应式。

正极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
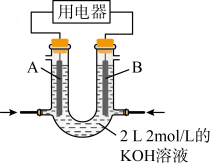
【推荐3】按要求回答下列问题:
(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是_______。
(2)下图是一氧化碳和氧在钌催化剂的表面形成化学键的过程。下列说法正确的是_______。
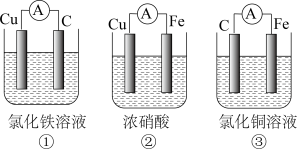
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是_______ (填序号)。_______ 。
(4)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。_______ (填“A”或“B”)处电极入口通甲烷,其电极反应式为_______ 。当消耗甲烷的体积为33.6 L(标准状况)时,假设电池的能量转化率为80%,导线中转移电子的物质的量为_______ 。
(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是_______。
A.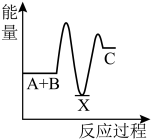 | B.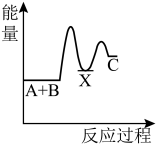 | C.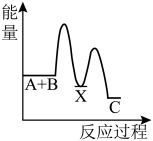 | D.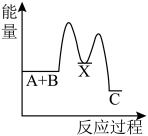 |
(2)下图是一氧化碳和氧在钌催化剂的表面形成化学键的过程。下列说法正确的是_______。
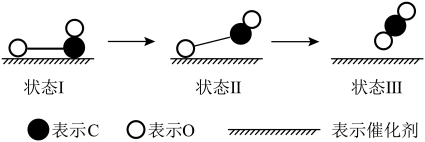
A. 和 和 均为酸性氧化物 均为酸性氧化物 | B.该过程中, 先断键成C和O 先断键成C和O |
| C.状态I到状态Ⅲ为放热过程 | D.图示表示 和 和 反应生成 反应生成 的过程 的过程 |
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是
(4)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
您最近一年使用:0次