化学反应与能量,是学习和研究化学原理的重要内容。
(1)铁、铜、铝是生活中使用广泛的金属,氯化铁溶液常用于腐蚀印刷电路铜板,若将此反应设计成原电池,则负极所用电极材料为___________ ,正极反应式为___________ 。
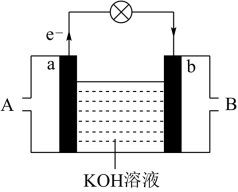
(2)将氢气与氧气的反应设计成燃料电池,其能量利用率更高,装置如图所示(a、b为多孔炭棒),其中___________ (填A或B)处电极入口通氢气,其电极反应式为___________ 。工作一段时间后正极区溶液的pH值___________ (填变大、减小或不变)。当消耗标况下氢气33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为___________ mol。
(1)铁、铜、铝是生活中使用广泛的金属,氯化铁溶液常用于腐蚀印刷电路铜板,若将此反应设计成原电池,则负极所用电极材料为
(2)将氢气与氧气的反应设计成燃料电池,其能量利用率更高,装置如图所示(a、b为多孔炭棒),其中

更新时间:2021-06-03 19:21:14
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计,请回答下列问题:

(1)以下叙述中,正确的是____ 。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为___________ ;乙为_________ 。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:___________________________________ 。
Ⅱ.氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池。
(1)如果是碱性燃料电池则负极反应方程式是:____________________ 。
(2)如果是酸性燃料电池则正极反应方程式是:___________________ 。

(1)以下叙述中,正确的是
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:
Ⅱ.氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池。
(1)如果是碱性燃料电池则负极反应方程式是:
(2)如果是酸性燃料电池则正极反应方程式是:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。回答下列问题:
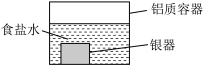
(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于__________ 腐蚀(填“化学”或“电化学”)。
(2)铝质容器作为__________ 极,银器的电极反应式为____________ 。
(3)处理过程中总反应的化学方程式为_______________ 。
(4)若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为____________ 。

(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于
(2)铝质容器作为
(3)处理过程中总反应的化学方程式为
(4)若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(i)燃料电池是目前正在探索的一种新型电池,目前已经使用的氢氧燃料电池的基本反应是正极:O2+2H2O+4e-=4OH-,回答下列问题:
(1)电解质溶液为____________ 。
(2)负极发生________ 反应(填“氧化”或“还原”)。写出其电极反应式___________ 。
(3)若反应后得到5.4 g液态水,此时氢氧燃料电池转移的电子数为________ 。
(ii)如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。

(1)片刻后可观察到的现象是(指悬吊的金属圈)________ 。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2)产生上述现象的原因是___________________________________ 。
(iii)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:___________________________ 。
(2)若将(1)中的反应设计成原电池,并写出正、负极电极反应式。
正极反应:______________________ ,负极反应:______________________ 。
(1)电解质溶液为
(2)负极发生
(3)若反应后得到5.4 g液态水,此时氢氧燃料电池转移的电子数为
(ii)如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。

(1)片刻后可观察到的现象是(指悬吊的金属圈)
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2)产生上述现象的原因是
(iii)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:
(2)若将(1)中的反应设计成原电池,并写出正、负极电极反应式。
正极反应:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】应用电化学原理,回答下列问题:
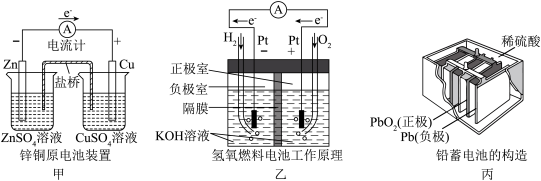
(1)上述三个装置中,负极反应物化学性质上的共同特点是_______ 。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是_______ 。
(3)乙中正极反应式为_______ ;若将H2换成CH4,则负极反应式为_______ 。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池的_______ 极相连接。

(1)上述三个装置中,负极反应物化学性质上的共同特点是
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是
(3)乙中正极反应式为
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是______ ,其电极反应式为______________________________ 。
(2)蓄电池的正极电极反应式为_________________________________ 。
(3)蓄电池工作时,其中电解质溶液的pH______ (增大、减小、不变)。
(1)蓄电池的负极是
(2)蓄电池的正极电极反应式为
(3)蓄电池工作时,其中电解质溶液的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】可燃冰(mCH4•nH2O)、氢气既是高效洁净的能源,又是重要的化工原料。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64kJ热量,则该条件下CH4完全燃烧的热化学方程式为____ 。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是____ 。
(3)某种氢燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:H2+O2--2e-=H2O
B极:O2+4e-=2O2-
该燃料电池工作时能量转化关系为____ ,A极是电池的____ 极。
(4)已知某甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO +3H2O,则电池负极的电极反应为
+3H2O,则电池负极的电极反应为____ ,随着电池不断放电,负极附近溶液的pH____ 。(填“增大”、“减小”或“不变”)
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64kJ热量,则该条件下CH4完全燃烧的热化学方程式为
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是
(3)某种氢燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:H2+O2--2e-=H2O
B极:O2+4e-=2O2-
该燃料电池工作时能量转化关系为
(4)已知某甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO
 +3H2O,则电池负极的电极反应为
+3H2O,则电池负极的电极反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】人们利用原电池原理制作了多种电池,以满足日常生活、生产和科学技术等方面的需要。请根据题中提供的信息,回答下列问题。
已知甲醇燃料电池的工作原理如图所示。该电池工作时,b口通入的物质为_______ (填化学式),该电池正极上的电极反应式为_______ ;当6.4g甲醇( )完全反应生成
)完全反应生成 时,有
时,有_______ mol电子发生转移。若将电池的电解质溶液换为KOH溶液,则负极反应式为_______ 。
已知甲醇燃料电池的工作原理如图所示。该电池工作时,b口通入的物质为
 )完全反应生成
)完全反应生成 时,有
时,有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】如图所示是原电池的装置图。请回答:

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___ ;反应进行一段时间后溶液酸性将__ (填“增强”“减弱”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___ ,B(负极)极材料为__ ,溶液C为___ 。
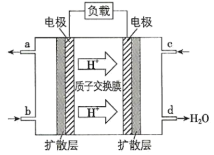
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
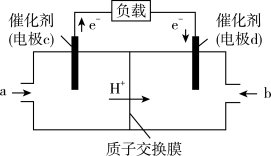
电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是__ (填“正极”或“负极”),c电极的反应方程式为__ 。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为__ L。

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】原电池是化学对人类的一项重大贡献。

(1)某兴趣小组为研究原电池原理,设计如图装置。
①a和b不连接时,烧杯中发生反应的离子方程式是__________________ 。
②a和b用导线连接,Cu极为原电池__ 极(填“正”或“负”),该电极反应式是_ ,溶液中的H+移向_____ (填“Cu”或“Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子,则理论上Zn片质量减轻________ g。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是_______ (填“a”或“b”)电极,该极的电极反应式为: ________
②电池工作一段时间后电解质溶液的pH________ (填“增大”“减小”或“不变”)

(1)某兴趣小组为研究原电池原理,设计如图装置。
①a和b不连接时,烧杯中发生反应的离子方程式是
②a和b用导线连接,Cu极为原电池
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子,则理论上Zn片质量减轻
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是
②电池工作一段时间后电解质溶液的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)请你将反应Cu+2FeCl3==CuCl2+2FeCl2设计成原电池并回答下列问题:
①写出电极反应式:正极_____________________ ;负极_________________________ 。
②画出你所设计的原电池简易装置图_________ 。
(2)该电池向外提供0.2mol 电子,负极材料的质量变化为________________________ 。
(3)利用反应2Cu+O2+2H2SO4==2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极的反应式为____________________________________________ 。
①写出电极反应式:正极
②画出你所设计的原电池简易装置图
(2)该电池向外提供0.2mol 电子,负极材料的质量变化为
(3)利用反应2Cu+O2+2H2SO4==2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极的反应式为
您最近一年使用:0次



