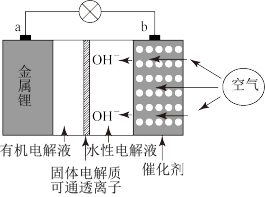
在一定条件下,化学能与电能可以相互转化。
(1)二甲醚燃料电池工作原理如图所示
①电极a为电池的_____ (填“正”或“负”)极。
②电极b的电极反应式:_____ 。
③标准状况下,消耗11.2LO2时,转移的电子数为____ mol。
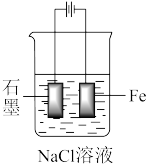
(2)①下图装置中石墨上发生_____ 反应,电极反应式为____ 。
②装置中Fe片____ (填“不易”或“容易”)被腐蚀,电极反应式为____ 。
③一段时间后,烧杯中的溶液的pH将____ (填“变大”、“变小”或“不变”)。
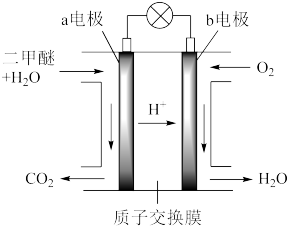
(1)二甲醚燃料电池工作原理如图所示

①电极a为电池的
②电极b的电极反应式:
③标准状况下,消耗11.2LO2时,转移的电子数为
(2)①下图装置中石墨上发生
②装置中Fe片
③一段时间后,烧杯中的溶液的pH将

更新时间:2021-06-26 09:44:35
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】将镁片和铝片用导线连接后插入NaOH溶液中,并在中间串联一个电流表,装置如图所示。

(1)镁片是该电池的___ 极。
(2)电子在该电池中的移动方向是从__ 片经导线流向__ 片。
(3)铝片上的电极反应式是__ ,该电极上发生了__ (填“氧化”或“还原”)反应。
(4)若将此装置中的NaOH溶液换成稀硫酸,则电池的负极材料是__ 。

(1)镁片是该电池的
(2)电子在该电池中的移动方向是从
(3)铝片上的电极反应式是
(4)若将此装置中的NaOH溶液换成稀硫酸,则电池的负极材料是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】观察图A、B,回答下列问题:
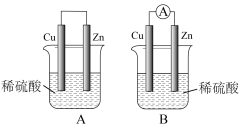
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡产生,再平行插入一块铜片,可观察到铜片_______ (填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为______ 。
(2)如果烧杯中最初装入的是2mol·L-1500mL的稀硫酸,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线流入铜电极),当在标准状况下收集到11.2L的氢气时,烧杯内溶液中溶质的物质的量浓度分别为(请指明溶质,溶液体积变化忽略不计)______ 、________ 。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-=== +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是______ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子

(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡产生,再平行插入一块铜片,可观察到铜片
(2)如果烧杯中最初装入的是2mol·L-1500mL的稀硫酸,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线流入铜电极),当在标准状况下收集到11.2L的氢气时,烧杯内溶液中溶质的物质的量浓度分别为(请指明溶质,溶液体积变化忽略不计)
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-===
 +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】据报导,我国已研制出“可充室温钠-二氧化碳电池”。该电池的总反应式为4Na+3CO2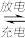 2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
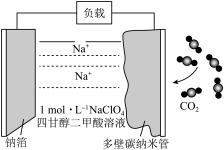
(1)放电时,钠箔为该电池的_____ 极(填“正”或“负”);电解质溶液中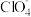 流向
流向_____ (填“钠箔”或“多壁碳纳米管”)电极。
(2)放电时每消耗3 mol CO2,转移电子数为______ 。
(3)充电时,碳纳米管连接直流电源的______ (填“正”或“负”)极,其电极反应式为_______ 。
(4)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似(如图所示),写出测定酒驾时负极的电极反应式:________ 。
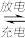 2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
(1)放电时,钠箔为该电池的
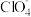 流向
流向(2)放电时每消耗3 mol CO2,转移电子数为
(3)充电时,碳纳米管连接直流电源的
(4)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似(如图所示),写出测定酒驾时负极的电极反应式:

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】电池在生产和生活中应用极其广泛,根据电化学原理回答下列问题。
(1)微型纽扣电池总反应为Ag2O+Zn+H2O=Zn(OH)2+2Ag,电解质溶液为KOH溶液,则负极材料为_______ ,正极的电极反应式为_______ 。
(2)甲醇(CH3OH)燃料电池为绿色化学电源,以NaOH溶液为电解质溶液时,负极的电极反应式为_______ ,该电池工作时,外电路每流过1mol e-,消耗标准状况下的O2_______ L。
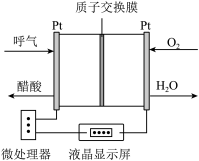
(3)ClO2是高效无毒的灭菌剂,目前已开发出用电解法制取ClO2的新工艺,简易装置如图所示:
若用上述甲醇燃料电池进行电解,则甲醇燃料电池的负极应连接该装置的_______ 电极(填字母),阳极产生ClO2的电极反应式为_______ 。
(1)微型纽扣电池总反应为Ag2O+Zn+H2O=Zn(OH)2+2Ag,电解质溶液为KOH溶液,则负极材料为
(2)甲醇(CH3OH)燃料电池为绿色化学电源,以NaOH溶液为电解质溶液时,负极的电极反应式为
(3)ClO2是高效无毒的灭菌剂,目前已开发出用电解法制取ClO2的新工艺,简易装置如图所示:

若用上述甲醇燃料电池进行电解,则甲醇燃料电池的负极应连接该装置的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】我国科学家设计了流式电解槽,直接将 送至电极表面,电还原
送至电极表面,电还原 制备有机物甲烷、乙烯、甲酸、乙酸、乙醇等,装置如图所示。
制备有机物甲烷、乙烯、甲酸、乙酸、乙醇等,装置如图所示。

回答下列问题:
(1)X极是_______ 极(填“阳”或“阴”),发生_______ (填“氧化”或“还原”)反应。
(2)电解槽工作时,氢离子由_______ 极区向_______ 极区迁移(填“X”或“Y”)。
(3)若M为 ,则Y极的电极反应式为
,则Y极的电极反应式为_______ 。
(4)若M为 ,则Y极的电极反应式为
,则Y极的电极反应式为_______ 。
(5)若Y极上生成1 mol ,则理论上得到
,则理论上得到_______ mol电子。
 送至电极表面,电还原
送至电极表面,电还原 制备有机物甲烷、乙烯、甲酸、乙酸、乙醇等,装置如图所示。
制备有机物甲烷、乙烯、甲酸、乙酸、乙醇等,装置如图所示。
回答下列问题:
(1)X极是
(2)电解槽工作时,氢离子由
(3)若M为
 ,则Y极的电极反应式为
,则Y极的电极反应式为(4)若M为
 ,则Y极的电极反应式为
,则Y极的电极反应式为(5)若Y极上生成1 mol
 ,则理论上得到
,则理论上得到
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
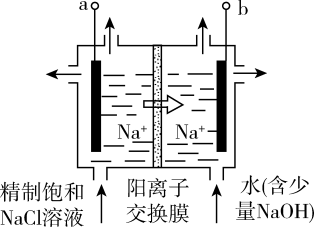
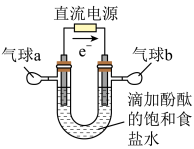
【推荐2】知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。
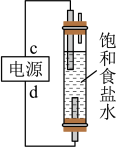
(1)图中,电解一段时间后,气球b中的气体是_____ (填化学式),U形管_____ (填“左”或“右”)边的溶液变红。
(2)利用图制作一种环保型消毒液发生器,可制备“84”消毒液的有效成分,则c为电源的_____ 极;该发生器中反应的总离子方程式为_____ 。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

①燃料电池B中的电极反应式分别为
负极:_____ ,
正极:_____ 。
②分析图3可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为_____ 。
(1)图中,电解一段时间后,气球b中的气体是

(2)利用图制作一种环保型消毒液发生器,可制备“84”消毒液的有效成分,则c为电源的

(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

①燃料电池B中的电极反应式分别为
负极:
正极:
②分析图3可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】能源是现代文明的原动力,随着常规能源的有限性以及环境问题的日益突出,以环保和可再生为特质的新能源越来越得到各国的重视。新能源包括风能、氢能、沼气、酒精、甲醇等,新能源的使用与研究在一定程度上助力中国实现“碳达峰、碳中和”。通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)目前,中国汽车行业已经发生翻天覆地的变化,电动汽车的发展异常耀眼。新能源汽车最重要的部件就是电池,现有一款铅酸电池,放电时的电池反应: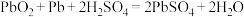 。据此判断下列叙述正确的是___________。
。据此判断下列叙述正确的是___________。
(2)如图所示为 燃料电池的装置(A、B为多孔碳棒):
燃料电池的装置(A、B为多孔碳棒):___________ (填A或B)处电极入口通甲烷,其电极反应式为___________ ;当消耗甲烷的体积为 (标准状况下)时,消耗
(标准状况下)时,消耗 的质量为
的质量为___________ g。
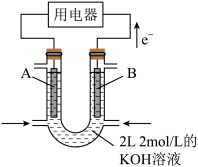
(3)用上述 燃料电池连接成如下装置。
燃料电池连接成如下装置。

乙池中X为阳离子交换膜,石墨电极(C)作___________ 极,写出乙池总反应的离子方程式___________ 。
(4)若将乙装置中两电极用导线直接相连,则铁发生___________ 腐蚀,写出碳棒的电极反应式:___________ 。若将乙装置中两电极连接电源的正负两极,铁连接电源的___________ 极(填“正”或“负”)可防止铁腐蚀,该种防护方法叫___________ 。
(5)若乙池中X为钠离子交换膜(只允许钠离子通过),则当甲池中消耗标准状况下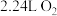 时,乙装置中阳极室溶液质量减少
时,乙装置中阳极室溶液质量减少___________ 克。
(6)若丙中要实现铁上镀银,b电极材料为___________ 。
(7)二氧化碳的资源化利用是目前研究的热点问题之一,西北工业大学团队研究锂-二氧化碳二次电池,取得了重大科研成果。该电池放电的总反应为 ,下列说法正确的是___________。
,下列说法正确的是___________。
(1)目前,中国汽车行业已经发生翻天覆地的变化,电动汽车的发展异常耀眼。新能源汽车最重要的部件就是电池,现有一款铅酸电池,放电时的电池反应:
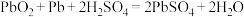 。据此判断下列叙述正确的是___________。
。据此判断下列叙述正确的是___________。| A.放电时,电能转化为化学能 | B. 是负极 是负极 |
C. 得电子,被氧化 得电子,被氧化 | D.电池放电时,溶液酸性增强 |
 燃料电池的装置(A、B为多孔碳棒):
燃料电池的装置(A、B为多孔碳棒): (标准状况下)时,消耗
(标准状况下)时,消耗 的质量为
的质量为
(3)用上述
 燃料电池连接成如下装置。
燃料电池连接成如下装置。
乙池中X为阳离子交换膜,石墨电极(C)作
(4)若将乙装置中两电极用导线直接相连,则铁发生
(5)若乙池中X为钠离子交换膜(只允许钠离子通过),则当甲池中消耗标准状况下
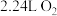 时,乙装置中阳极室溶液质量减少
时,乙装置中阳极室溶液质量减少(6)若丙中要实现铁上镀银,b电极材料为
(7)二氧化碳的资源化利用是目前研究的热点问题之一,西北工业大学团队研究锂-二氧化碳二次电池,取得了重大科研成果。该电池放电的总反应为
 ,下列说法正确的是___________。
,下列说法正确的是___________。| A.该电池的电解液可以是稀硫酸 |
B.放电时,若消耗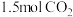 时,转移 时,转移 电子 电子 |
| C.放电时,电子从锂电极流出,通过电解液流回锂电极,构成闭合回路 |
| D.放电时,锂电极作正极 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图实验(图中所用电极均为惰性电极):
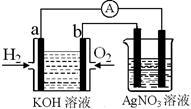
(1)对于氢氧燃料电池中,下列表达不正确的是________
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________ (溶液体积变化忽略不计)
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图实验(图中所用电极均为惰性电极):

(1)对于氢氧燃料电池中,下列表达不正确的是
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上为了处理含有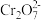 酸性工业废水,采用下面的处理方法:往工业废水加入适量NaCl,以Fe为电极进行电解,经过一段时间,有
酸性工业废水,采用下面的处理方法:往工业废水加入适量NaCl,以Fe为电极进行电解,经过一段时间,有 和
和 沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
(1)两极发生反应的电极反应式:
阴极:________________________________________ 。
阳极:________________________________________ 。
(2)写出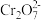 变为
变为 离子方程式:
离子方程式:_______________________________ 。
(3)废水由酸性变为碱性的原因是_______________ 。
(4)____  填“能”或“不能”
填“能”或“不能” 改用石墨电极,原因是
改用石墨电极,原因是______________ 。
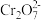 酸性工业废水,采用下面的处理方法:往工业废水加入适量NaCl,以Fe为电极进行电解,经过一段时间,有
酸性工业废水,采用下面的处理方法:往工业废水加入适量NaCl,以Fe为电极进行电解,经过一段时间,有 和
和 沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题: (1)两极发生反应的电极反应式:
阴极:
阳极:
(2)写出
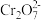 变为
变为 离子方程式:
离子方程式:(3)废水由酸性变为碱性的原因是
(4)
 填“能”或“不能”
填“能”或“不能” 改用石墨电极,原因是
改用石墨电极,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】电化学综合应用
(Ⅰ) 选择合适的图像:
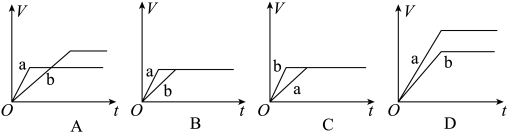
(1)将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是_____________ 。
(2)将(1)中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图像是__________。
(Ⅱ)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
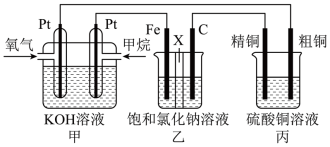
(3)甲烷燃料电池负极反应式是_________________________ 。
(4)乙装置中铁极的电极反应式为_______________________ 。
(5)检验石墨(C)极反应产物的方法是_____________________ 。
(6)若在标准状况下,有2.24 L氧气参加反应,丙装置中阴极析出铜的质量为________ g。
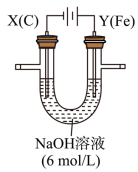
(Ⅲ)Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的高效水处理剂,其电解制法如图所示。电解过程中,两极均有气体产生,Y极区域溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍澄清。查阅资料得知,高铁酸根离子(FeO )在溶液中呈紫红色。
)在溶液中呈紫红色。
(7)电解过程中,X极区溶液的pH___________ (填“增大”“减小”或“不变”)。
(8)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-===FeO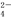 +4H2O和
+4H2O和__________ 。
(9)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少__________ g。
(10)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2。该电池正极发生的反应的电极反应式为____________________________ 。
(Ⅰ) 选择合适的图像:

(1)将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是
(2)将(1)中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图像是__________。
(Ⅱ)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(3)甲烷燃料电池负极反应式是
(4)乙装置中铁极的电极反应式为
(5)检验石墨(C)极反应产物的方法是
(6)若在标准状况下,有2.24 L氧气参加反应,丙装置中阴极析出铜的质量为

(Ⅲ)Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的高效水处理剂,其电解制法如图所示。电解过程中,两极均有气体产生,Y极区域溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍澄清。查阅资料得知,高铁酸根离子(FeO
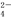 )在溶液中呈紫红色。
)在溶液中呈紫红色。(7)电解过程中,X极区溶液的pH
(8)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-===FeO
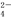 +4H2O和
+4H2O和(9)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
(10)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2。该电池正极发生的反应的电极反应式为
您最近一年使用:0次

 移向
移向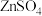 ”或“
”或“ ”)。
”)。