化学合成的成果常需要一定的时间才得以应用于日常生活。例如化合物A合成于1929 年,至1969年才被用作牙膏的添加剂和补牙填充剂成分,A是离子晶体,由NaF和NaPO3在熔融状态下反应得到,它易溶于水,阴离子水解产生氟离子和对人体无毒的另一种离子。
(1)写出合成A的反应方程式____ 。
(2)写出A中阴离子水解反应的离子方程式____ 。
(1)写出合成A的反应方程式
(2)写出A中阴离子水解反应的离子方程式
更新时间:2021-07-01 20:24:50
|
【知识点】 酸碱理论和水溶液中的离子平衡
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】从某些性质看, NH3和H2O,NH 和H3O+,OH-和NH
和H3O+,OH-和NH ,NH
,NH 和O2-两两相似。
和O2-两两相似。
(1)试写出乙酸在液态氨中的形式_______ 。在水溶液中CH3COOH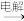 CH4+CO2,则乙酸在液态氨中的相应反应的方程式为
CH4+CO2,则乙酸在液态氨中的相应反应的方程式为_______ 。
(2)在液态氟化氢中,SbF5成为导电强的溶液,其离子方程式为_______ ,生成的两种物质的几何构型为_______ ,_______ 。
 和H3O+,OH-和NH
和H3O+,OH-和NH ,NH
,NH 和O2-两两相似。
和O2-两两相似。(1)试写出乙酸在液态氨中的形式
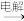 CH4+CO2,则乙酸在液态氨中的相应反应的方程式为
CH4+CO2,则乙酸在液态氨中的相应反应的方程式为(2)在液态氟化氢中,SbF5成为导电强的溶液,其离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】乙酰胆碱是一种神经递质,能特异性地作用于各类胆碱受体,可导致骨骼肌收缩、血管舒张等生理效应,然而,其化学性质不稳定,在组织内可迅速被乙酰胆碱酯酶水解成胆碱和乙酸而失活(反应方程式如下)。由于浓度极低,水解生成的乙酸几乎完全电离。乙酰胆碱的浓度可以通过检测其水解时pH变化而得。现将15mL含有乙酰胆碱的样品与乙酰胆碱酯酶混合保温后,pH由原来的7.65变为6.87,假设不考虑任何缓冲作用,可求得水解中产生的H+浓度为_______ mol/L,该样品中乙酰胆碱的物质的量为_______ mol。
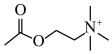 +H2O→
+H2O→ +
+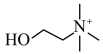 +H+
+H+
 +H2O→
+H2O→ +
+ +H+
+H+
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知溶液的导电性强弱由溶液中离子的浓度大小及离子所带电荷数决定。离子浓度越大,电荷数越多,则溶液导电性越强。某兴趣小组同学做了以下实验:

(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质 可以是
可以是___________ (填序号)。
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)上述物质中哪些是电解质___________ (填序号)。
(3)在电解质溶液的导电性实验装置(如图1所示)中,若向某一电解质溶液中逐滴加另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮(如图2)的是___________ (填字母)。
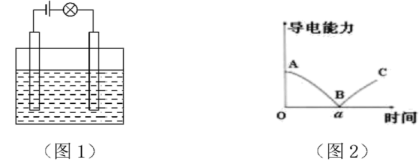
(4)写出上述实验中灯泡“由亮变暗,至熄灭”现象背后的离子反应方程式:___________ 。
(5)试推测“硫酸中逐滴加入氢氧化钠溶液”,灯泡亮度的变化:___________ ,变化的原因___________ (用离子方程式解释)。
(6)某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论中,正确的是___________
图A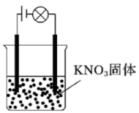 图B
图B

(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质
 可以是
可以是①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)上述物质中哪些是电解质
(3)在电解质溶液的导电性实验装置(如图1所示)中,若向某一电解质溶液中逐滴加另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮(如图2)的是___________ (填字母)。
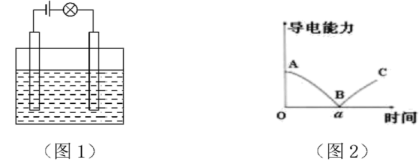
| A.盐酸中逐滴加入食盐溶液 |
| B.硫酸中逐滴加入氢氧化钠溶液 |
| C.石灰乳中滴加稀盐酸 |
| D.硫酸中逐滴加入氢氧化钡溶液 |
(5)试推测“硫酸中逐滴加入氢氧化钠溶液”,灯泡亮度的变化:
(6)某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论中,正确的是___________
图A
 图B
图B
| A.硝酸钾固体不是电解质 |
| B.硝酸钾溶液是电解质 |
| C.硝酸钾在水溶液中电离出了可以自由移动的离子 |
| D.在硝酸钾溶液中,水电离出了大量的离子 |
您最近一年使用:0次



