I.(1)如图是化学反应中物质变化和能量变化的示意图。
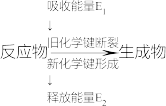
在锌与稀盐酸的反应中,E1______ E2(填“>”或“<”或“=”)
(2)工业上利用 和
和 比在催化剂作用下合成甲醇:
比在催化剂作用下合成甲醇: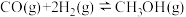 ,已知反应中有关物质的化学键键能数据如下表所示:
,已知反应中有关物质的化学键键能数据如下表所示:
则 生成
生成
 放出
放出______  热量。
热量。
(3)化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。
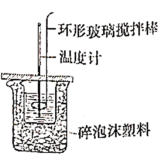
a.用量筒量取
 盐酸倒入如图装置的小烧杯中,测出盐酸温度。
盐酸倒入如图装置的小烧杯中,测出盐酸温度。
b.用另一量筒量取

 溶液,并用另一温度计测出其温度。
溶液,并用另一温度计测出其温度。
c.将 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
①实验中,倒入 溶液的正确操作是
溶液的正确操作是_______ 。
A.一次性快速倒入 B.分3次倒入 C.边搅拌边慢慢倒入
②若将各含 溶质的
溶质的 稀溶液、
稀溶液、 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的关系为
稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的关系为______ 。
II.甲烷燃料电池。已知电池的总反应为 ,
,
①负极的电极反应式为_______ 。
②当消耗甲烷11.2L(标准状况下时),则导线中转移的电子的物质的量为______ mol。

在锌与稀盐酸的反应中,E1
(2)工业上利用
 和
和 比在催化剂作用下合成甲醇:
比在催化剂作用下合成甲醇: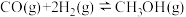 ,已知反应中有关物质的化学键键能数据如下表所示:
,已知反应中有关物质的化学键键能数据如下表所示:| 化学键 |  |  |  |  |  |
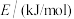 | 436 | 343 | 1076 | 465 | 413 |
则
 生成
生成
 放出
放出 热量。
热量。(3)化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。

a.用量筒量取

 盐酸倒入如图装置的小烧杯中,测出盐酸温度。
盐酸倒入如图装置的小烧杯中,测出盐酸温度。b.用另一量筒量取


 溶液,并用另一温度计测出其温度。
溶液,并用另一温度计测出其温度。c.将
 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。①实验中,倒入
 溶液的正确操作是
溶液的正确操作是A.一次性快速倒入 B.分3次倒入 C.边搅拌边慢慢倒入
②若将各含
 溶质的
溶质的 稀溶液、
稀溶液、 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的关系为
稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的关系为II.甲烷燃料电池。已知电池的总反应为
 ,
,①负极的电极反应式为
②当消耗甲烷11.2L(标准状况下时),则导线中转移的电子的物质的量为
更新时间:2021-07-02 16:52:24
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示:
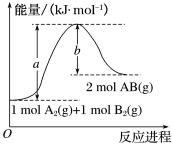
①该反应的ΔH___ 0(填“大于”“小于”或“等于”)。
②反应物的总键能为___ 。
③写出该反应的热化学方程式___ 。
(2)已知拆开1molH—H键、1molN—H键、1molN≡N键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___ 。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=-1048.9kJ·mol-1
上述反应热效应之间的关系式为ΔH4=___ ,联氨和N2O4可作为火箭推进剂的主要原因为___ 。(至少答两条)
Ⅱ.合成氨工业在工农业生产、生活中有着重要作用。反应原理为3H2(g)+N2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
(4)在T℃时,将一定物质的量的H2和N2置于一容积不变的密闭容器中。
①下列各项能说明该反应已达到平衡状态的是___ (填序号)。
a.容器内的压强不再随时间变化 b.3v(N2)=v(H2)
c.3v正(H2)=2v逆(NH3) d.混合气体的密度保持不变
②上述反应达到平衡后,其他条件不变,升高温度,v逆___ (填“增大”“不变”或“减小”),v正和v逆的关系为v正___ v逆(填“>”“=”或“<”),最后二者相等。
③该条件下达到平衡时,向容器内充入惰性气体,增大容器内的压强,NH3的体积分数将___ (填“变大”“不变”或“变小”)。
(5)在T℃时,将一定物质的量的H2和N2置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可是___ 。
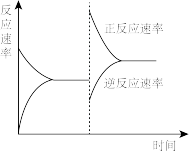
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示:

①该反应的ΔH
②反应物的总键能为
③写出该反应的热化学方程式
(2)已知拆开1molH—H键、1molN—H键、1molN≡N键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=-1048.9kJ·mol-1
上述反应热效应之间的关系式为ΔH4=
Ⅱ.合成氨工业在工农业生产、生活中有着重要作用。反应原理为3H2(g)+N2(g)
 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。(4)在T℃时,将一定物质的量的H2和N2置于一容积不变的密闭容器中。
①下列各项能说明该反应已达到平衡状态的是
a.容器内的压强不再随时间变化 b.3v(N2)=v(H2)
c.3v正(H2)=2v逆(NH3) d.混合气体的密度保持不变
②上述反应达到平衡后,其他条件不变,升高温度,v逆
③该条件下达到平衡时,向容器内充入惰性气体,增大容器内的压强,NH3的体积分数将
(5)在T℃时,将一定物质的量的H2和N2置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可是

a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】I.完成下列问题。
(1)在25°C,101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧热的热化学方程式为_______ 。
(2)已知在一定温度下:
C(s)+CO2(g) 2CO(g) 平衡常数K1;
2CO(g) 平衡常数K1;
C(s)+H2O(g) CO(g)+H2(g) 平衡常数K2
CO(g)+H2(g) 平衡常数K2
CO(g)+ H2O(g) H2(g)+ CO2(g) 平衡常数K3
H2(g)+ CO2(g) 平衡常数K3
则K1、 K2、K3之间的关系是_______ 。
II.甲醇的合成
(3)已知:CO(g)+ O2(g)= CO2(g) ΔH1=-283 kJ/mol
O2(g)= CO2(g) ΔH1=-283 kJ/mol
H2(g)+ O2(g)= H2O(g) ΔH2= -242 kJ/mol
O2(g)= H2O(g) ΔH2= -242 kJ/mol
CH3OH(g)+ O2(g)= CO2(g)+ 2H2O(g) ΔH3= -676 kJ/mol
O2(g)= CO2(g)+ 2H2O(g) ΔH3= -676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g)+ 2H2(g)= CH3OH(g)。该反应的ΔH为_______ kJ/mol。
III.某化学兴趣小组要完成中和反应反应热的测定实验。
(4)实验桌上备有量热计(含保温装置和温度计)、胶头滴管、0.5mol·L-1盐酸、0.55mol·L-1氢氧化钠溶液,实验尚缺少的玻璃用品是_______ 。
(5)他们记录的实验数据如下:
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ·C-1 ·kg-1,各物质的密度均为1g·cm-3。根据实验结果写出氢氧化钠溶液与盐酸反应的热化学方程式:_______ 。
(1)在25°C,101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧热的热化学方程式为
(2)已知在一定温度下:
C(s)+CO2(g)
 2CO(g) 平衡常数K1;
2CO(g) 平衡常数K1;C(s)+H2O(g)
 CO(g)+H2(g) 平衡常数K2
CO(g)+H2(g) 平衡常数K2CO(g)+ H2O(g)
 H2(g)+ CO2(g) 平衡常数K3
H2(g)+ CO2(g) 平衡常数K3则K1、 K2、K3之间的关系是
II.甲醇的合成
(3)已知:CO(g)+
 O2(g)= CO2(g) ΔH1=-283 kJ/mol
O2(g)= CO2(g) ΔH1=-283 kJ/molH2(g)+
 O2(g)= H2O(g) ΔH2= -242 kJ/mol
O2(g)= H2O(g) ΔH2= -242 kJ/molCH3OH(g)+
 O2(g)= CO2(g)+ 2H2O(g) ΔH3= -676 kJ/mol
O2(g)= CO2(g)+ 2H2O(g) ΔH3= -676 kJ/mol以CO(g)和H2(g)为原料合成甲醇的反应为CO(g)+ 2H2(g)= CH3OH(g)。该反应的ΔH为
III.某化学兴趣小组要完成中和反应反应热的测定实验。
(4)实验桌上备有量热计(含保温装置和温度计)、胶头滴管、0.5mol·L-1盐酸、0.55mol·L-1氢氧化钠溶液,实验尚缺少的玻璃用品是
(5)他们记录的实验数据如下:
| 实验用品 | 溶液温度 | 生成1mol H2O放出的热量 | |||
| t1 | t2 | ||||
| a | 50mL 0.55mol·L-1NaOH溶液 | 50mL 0.5mol·L-1 HCl溶液 | 20°C | 23.3°C | |
| b | 50mL 0.55mol·L-1NaOH溶液 | 50mL 0.5mol·L-1 HCl溶液 | 20°C | 23.5°C | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ·C-1 ·kg-1,各物质的密度均为1g·cm-3。根据实验结果写出氢氧化钠溶液与盐酸反应的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】防治环境污染,改善生态环境已成为全球共识。回答下列问题:
(1)汽车尾气中NO生成过程中的能量变化如图所示。生成1 mol
___________ (填“吸收”或“放出”)___________ kJ的热量。
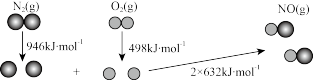
(2)汽车尾气(含CO、 和
和 等)是城市空气的污染源之一,三元催化可以将汽车尾气中的CO和
等)是城市空气的污染源之一,三元催化可以将汽车尾气中的CO和 进行净化处理,写出NO和CO反应转化为无害气体的化学方程式
进行净化处理,写出NO和CO反应转化为无害气体的化学方程式___________ 。
(3)硝酸工业废气中有氮氧化物( ),利用尿素消除
),利用尿素消除 污染的转化反应为:
污染的转化反应为:
ⅰ.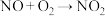 ,ⅱ.
,ⅱ.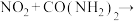 无污染气体。
无污染气体。
尿素中C元素的化合价___________ ,反应ⅱ的化学方程式为___________ 。
(4)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。

①在酸性NaClO溶液中,HClO氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(5)加入过量次氯酸钠可使废水中 完全转化为
完全转化为 ,而本身被还原为NaCl。
,而本身被还原为NaCl。
①检验废水中是否存在 的方法是
的方法是___________ 。
②若处理废水产生了0.448 L (标准状况),则需消耗浓度为2 mol/L的次氯酸钠的体积为
(标准状况),则需消耗浓度为2 mol/L的次氯酸钠的体积为___________ mL。
(1)汽车尾气中NO生成过程中的能量变化如图所示。生成1 mol


(2)汽车尾气(含CO、
 和
和 等)是城市空气的污染源之一,三元催化可以将汽车尾气中的CO和
等)是城市空气的污染源之一,三元催化可以将汽车尾气中的CO和 进行净化处理,写出NO和CO反应转化为无害气体的化学方程式
进行净化处理,写出NO和CO反应转化为无害气体的化学方程式(3)硝酸工业废气中有氮氧化物(
 ),利用尿素消除
),利用尿素消除 污染的转化反应为:
污染的转化反应为:ⅰ.
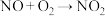 ,ⅱ.
,ⅱ.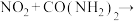 无污染气体。
无污染气体。尿素中C元素的化合价
(4)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成
 和
和 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
(5)加入过量次氯酸钠可使废水中
 完全转化为
完全转化为 ,而本身被还原为NaCl。
,而本身被还原为NaCl。①检验废水中是否存在
 的方法是
的方法是②若处理废水产生了0.448 L
 (标准状况),则需消耗浓度为2 mol/L的次氯酸钠的体积为
(标准状况),则需消耗浓度为2 mol/L的次氯酸钠的体积为
您最近一年使用:0次
【推荐1】化学反应伴随能量变化,获取反应能量变化有多种途径。
(1)下列反应中,属于吸热反应的是___________(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
则2H2(g)+O2(g)=2H2O(g)ΔH=___________ kJ·mol-1。
②通过物质所含能量计算。
已知反应A+B=C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应ΔH=___________ 。
③通过盖斯定律计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+ O2(g)=Na2O(s)ΔH=-414kJ·mol-1
O2(g)=Na2O(s)ΔH=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol·L-1盐酸,则还需加入___________ (填字母)。
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
(1)下列反应中,属于吸热反应的是___________(填字母)。
| A.Na2O与水反应 | B.甲烷的燃烧反应 | C.CaCO3受热分解 | D.锌与盐酸反应 |
①通过化学键的键能计算。已知:
| 化学键 | H—H | O=O | O—H |
| 键能/(kJ·mol-1) | 436 | 498 | 463.4 |
②通过物质所含能量计算。
已知反应A+B=C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应ΔH=
③通过盖斯定律计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+
 O2(g)=Na2O(s)ΔH=-414kJ·mol-1
O2(g)=Na2O(s)ΔH=-414kJ·mol-1Ⅱ.2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol·L-1盐酸,则还需加入
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65 kJ的热量。
①写出反应的热化学方程式:________________________________ ,其中氧化剂是____________ ,若反应中当有1molN2生成时转移的电子物质的量是__________ 。
②此反应用于火箭推进,除释放大量热和产生气体外,还有一个很大的优点是___________ 。
(2)已知:2CO(g) + O2(g) = 2CO2(g) △H= -566 kJ/mol
Na2O2(s) + CO2(g) = Na2CO3(s) + O2(g) △H= -226 kJ/mol
O2(g) △H= -226 kJ/mol
请写出常温下,过氧化钠与一氧化碳反应生成碳酸钠的热化学方程式:____________________ 。
(3)中学化学实验中的中和热的测定所需的玻璃仪器除了大烧杯、小烧杯、量筒外还有:_____ ,在大小烧杯之间填满碎泡沫(或纸条)其作用是_____ 。
①写出反应的热化学方程式:
②此反应用于火箭推进,除释放大量热和产生气体外,还有一个很大的优点是
(2)已知:2CO(g) + O2(g) = 2CO2(g) △H= -566 kJ/mol
Na2O2(s) + CO2(g) = Na2CO3(s) +
 O2(g) △H= -226 kJ/mol
O2(g) △H= -226 kJ/mol请写出常温下,过氧化钠与一氧化碳反应生成碳酸钠的热化学方程式:
(3)中学化学实验中的中和热的测定所需的玻璃仪器除了大烧杯、小烧杯、量筒外还有:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】Ⅰ.实验室测定中和热的步骤如下(如图)

第一步:量取40.0mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
第二步:量取40.0mL 0.55mol/L NaOH溶液,测量温度;
第三步:将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)图中仪器A的名称是_______ 。
(2)NaOH溶液稍过量的原因_______ 。
(3)加入NaOH溶液的正确操作是_______(填字母)。
(4)若实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量_______ (填“相等”“不相等”),若实验操作均正确,则所求中和热_______ (填“相等”“不相等”)。
Ⅱ.
(5)已知拆开1 mol H-H、1 mol N-H、1 mol N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_______ 。
(6)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则C2H2燃烧热的热化学方程式为_______ 。
(7)已知两个氢气燃烧生成水的热化学方程式:
H2(g)+ O2(g)=H2O(g) ΔH=a kJ·mol-1
O2(g)=H2O(g) ΔH=a kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol-1
请回答下列问题(|b|表示b的绝对值):
①若2 mol H2(g)完全燃烧生成水蒸气,则放出的热量_______ (填“>”“<”或“=”)|b| kJ。
②反应热的关系:2a_______ (填“>”“<”或“=”)b。
③若已知H2(g)+ O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为
O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为_______ 。
(8)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1= +108.0 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2= -534.0 kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH3=_______ kJ·mol-1。

第一步:量取40.0mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
第二步:量取40.0mL 0.55mol/L NaOH溶液,测量温度;
第三步:将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)图中仪器A的名称是
(2)NaOH溶液稍过量的原因
(3)加入NaOH溶液的正确操作是_______(填字母)。
| A.沿玻璃棒缓慢加入 | B.分三次均匀加入 | C.一次迅速加入 | D.用滴定管小心滴加 |
Ⅱ.
(5)已知拆开1 mol H-H、1 mol N-H、1 mol N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
(6)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则C2H2燃烧热的热化学方程式为
(7)已知两个氢气燃烧生成水的热化学方程式:
H2(g)+
 O2(g)=H2O(g) ΔH=a kJ·mol-1
O2(g)=H2O(g) ΔH=a kJ·mol-12H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol-1
请回答下列问题(|b|表示b的绝对值):
①若2 mol H2(g)完全燃烧生成水蒸气,则放出的热量
②反应热的关系:2a
③若已知H2(g)+
 O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为
O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为(8)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1= +108.0 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2= -534.0 kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH3=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】依据原电池原理,回答下列问题:
(1)如图是依据氧化还原反应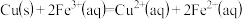 设计的原电池装置。
设计的原电池装置。
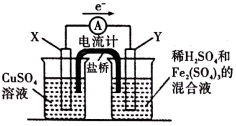
①电极Y的材料是______ (填化学名称)。
②X上发生的电极反应式为______ 。
(2)如图是使用固体电解质的燃料电池,装置中以稀土金属材料作惰性电极,在两极上分别通入 和空气,其中固体电解质是掺杂了
和空气,其中固体电解质是掺杂了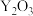 的
的 固体,它在高温下能传导正极生成的
固体,它在高温下能传导正极生成的 离子(
离子(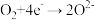 )。
)。
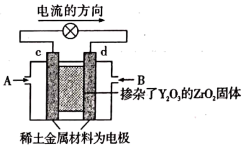
①c电极为______ (填“正”或“负”)极。
②d上的电极反应式为______ 。
③如果消耗甲烷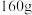 ,假设化学能完全转化为电能,则转移电子的数目为
,假设化学能完全转化为电能,则转移电子的数目为______ (用 表示),需消耗标准状况下氧气的体积为
表示),需消耗标准状况下氧气的体积为______  。
。
(1)如图是依据氧化还原反应
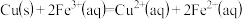 设计的原电池装置。
设计的原电池装置。
①电极Y的材料是
②X上发生的电极反应式为
(2)如图是使用固体电解质的燃料电池,装置中以稀土金属材料作惰性电极,在两极上分别通入
 和空气,其中固体电解质是掺杂了
和空气,其中固体电解质是掺杂了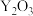 的
的 固体,它在高温下能传导正极生成的
固体,它在高温下能传导正极生成的 离子(
离子(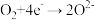 )。
)。
①c电极为
②d上的电极反应式为
③如果消耗甲烷
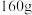 ,假设化学能完全转化为电能,则转移电子的数目为
,假设化学能完全转化为电能,则转移电子的数目为 表示),需消耗标准状况下氧气的体积为
表示),需消耗标准状况下氧气的体积为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】工业上,利用正丁烷可以获得乙烯、丙烯等化工原料。
反应1: ;
;
反应2: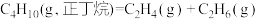 。
。
(1)工业上利用正丁烷获得乙烯、丙烯等化工原料,属于石油炼制方法中的石油的___________ (填分留、裂化或裂解)。
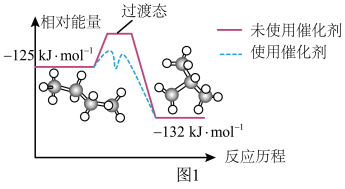
(2)正丁烷和异丁烷之间转化的能量变化如图1所示。下列有关催化剂的叙述错误的是________(填标号)。
(3)丁烷、空气和氢氧化钾溶液组成的燃料电池(如图2所示)是一种高效能的车载电池,则a电极为___________ (填正或负)极,其电极反应式为___________ 。
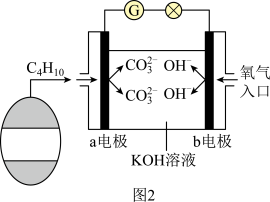
(4)正丁烷分解可生成乙烯。
①乙烯分子中有___________ 个σ键和___________ 个π键,其中碳原子未杂化的___________ 轨道形成π键;
②分子中多一个碳原子且与乙烯互为同系物的有机物M,写出M通入溴的四氯化碳溶液的反应化学方程式___________ 。
反应1:
 ;
;反应2:
 。
。(1)工业上利用正丁烷获得乙烯、丙烯等化工原料,属于石油炼制方法中的石油的
(2)正丁烷和异丁烷之间转化的能量变化如图1所示。下列有关催化剂的叙述错误的是________(填标号)。

| A.能改变反应活化能 | B.能降低反应焓变 |
| C.能加快反应速率 | D.能增大平衡常数 |

(4)正丁烷分解可生成乙烯。
①乙烯分子中有
②分子中多一个碳原子且与乙烯互为同系物的有机物M,写出M通入溴的四氯化碳溶液的反应化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】生活中形式多样化的电池,满足不同的市场需求。图中是几种不同类型的原电池装置。
(1)某实验小组设计了如图甲所示装置:a为铝棒,b为镁棒。

①若容器中盛有NaOH溶液,b极电极反应式为
②若容器中盛有稀硫酸,b极的电极反应式是
(2)铜—银原电池装置如图乙所示,下列有关叙述正确的是_______(填标号)。
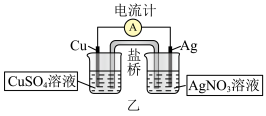
注:盐桥的作用为形成闭合回路。
| A.银电极上发生氧化反应 |
| B.电池工作一段时间后,铜极的质量增加 |
| C.取出盐桥后,电流计依旧发生偏转 |
| D.电池工作时,每转移0.1mol电子,两电极的质量差会增加14g |
(3)由CH4和O2组成的燃料电池的结构如图丙所示。
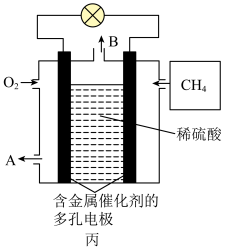
①燃料电池的负极反应式是
②当消耗1.6g甲烷时,消耗氧气的体积为
您最近一年使用:0次



