高铁酸钾(K2FeO4)是一种新型选择性氧化剂和超铁电池的正极材料,在水处理、有机合成、电池工业等方面展现出广阔的应用前景。早在1951年,Thompson等已成功地利用化学方法合成了纯度为97%~99%的K2FeO4。已知相关物质的标准电极电势如下:
 +8H++3e-→Fe3++4H2O
+8H++3e-→Fe3++4H2O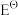 =2.20V
=2.20V
 +4H2O+3e-→Fe(OH)3+5OH-
+4H2O+3e-→Fe(OH)3+5OH-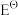 =0.72V
=0.72V
2HClO+2H++2e-→Cl2+2H2O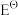 =1.611V。
=1.611V。
ClO-+H2O+2e-→Cl-+2OH-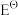 =0.81V
=0.81V
Cl2+2e-→2Cl-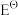 =1.358V
=1.358V
(1)试写出以Fe(NO3)3为铁源、KClO为氧化剂,在KOH溶液中制备K2FeO4的离子方程式_______ 。
(2)研究发现,Fe(OH)3能催化溶液中K2FeO4的分解。在相同条件下,分别以Fe(NO3)3和K3[FeF6]为原料制备K2FeO4,哪种铁源制备K2FeO4的产率较高______ ?简述理由_______ 。
(3)高铁酸在水溶液中有4种形体,其酸常数为pKa1=1.6、pKa2=3.5、pKa3=7.3.pH=1.0的该溶液4种形体中哪2种是主要的?写出它们的化学式_______ 。
(4)K2FeO4在KOH溶液中可将甲苯氧化成苯甲醛, 转化为红棕色沉淀和绿色溶液(绿色是由
转化为红棕色沉淀和绿色溶液(绿色是由 呈现的),该绿色溶液与适量S2-发生氧化还原反应生成深色沉淀,组成分析发现该沉淀为3种物质的混合物,写出它们的化学式
呈现的),该绿色溶液与适量S2-发生氧化还原反应生成深色沉淀,组成分析发现该沉淀为3种物质的混合物,写出它们的化学式________ 。
(5)以K2FeO4作为锂离子电池的正极材料,可嵌入/脱嵌Li+离子。1.00gK2FeO4的理论容量为406mAh,请通过计算写出K2FeO4可逆嵌入/脱嵌Li+的方程式__________ 。
 +8H++3e-→Fe3++4H2O
+8H++3e-→Fe3++4H2O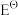 =2.20V
=2.20V +4H2O+3e-→Fe(OH)3+5OH-
+4H2O+3e-→Fe(OH)3+5OH-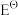 =0.72V
=0.72V2HClO+2H++2e-→Cl2+2H2O
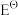 =1.611V。
=1.611V。ClO-+H2O+2e-→Cl-+2OH-
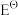 =0.81V
=0.81VCl2+2e-→2Cl-
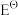 =1.358V
=1.358V(1)试写出以Fe(NO3)3为铁源、KClO为氧化剂,在KOH溶液中制备K2FeO4的离子方程式
(2)研究发现,Fe(OH)3能催化溶液中K2FeO4的分解。在相同条件下,分别以Fe(NO3)3和K3[FeF6]为原料制备K2FeO4,哪种铁源制备K2FeO4的产率较高
(3)高铁酸在水溶液中有4种形体,其酸常数为pKa1=1.6、pKa2=3.5、pKa3=7.3.pH=1.0的该溶液4种形体中哪2种是主要的?写出它们的化学式
(4)K2FeO4在KOH溶液中可将甲苯氧化成苯甲醛,
 转化为红棕色沉淀和绿色溶液(绿色是由
转化为红棕色沉淀和绿色溶液(绿色是由 呈现的),该绿色溶液与适量S2-发生氧化还原反应生成深色沉淀,组成分析发现该沉淀为3种物质的混合物,写出它们的化学式
呈现的),该绿色溶液与适量S2-发生氧化还原反应生成深色沉淀,组成分析发现该沉淀为3种物质的混合物,写出它们的化学式(5)以K2FeO4作为锂离子电池的正极材料,可嵌入/脱嵌Li+离子。1.00gK2FeO4的理论容量为406mAh,请通过计算写出K2FeO4可逆嵌入/脱嵌Li+的方程式
更新时间:2021-07-09 17:38:40
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】已知溶液的导电性强弱由溶液中离子的浓度大小及离子所带电荷数决定。离子浓度越大,电荷数越多,则溶液导电性越强。某兴趣小组同学做了以下实验:

(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质 可以是
可以是___________ (填序号)。
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)上述物质中哪些是电解质___________ (填序号)。
(3)在电解质溶液的导电性实验装置(如图1所示)中,若向某一电解质溶液中逐滴加另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮(如图2)的是___________ (填字母)。
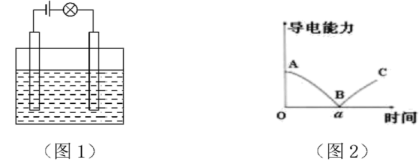
(4)写出上述实验中灯泡“由亮变暗,至熄灭”现象背后的离子反应方程式:___________ 。
(5)试推测“硫酸中逐滴加入氢氧化钠溶液”,灯泡亮度的变化:___________ ,变化的原因___________ (用离子方程式解释)。
(6)某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论中,正确的是___________
图A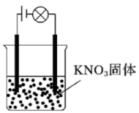 图B
图B

(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质
 可以是
可以是①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)上述物质中哪些是电解质
(3)在电解质溶液的导电性实验装置(如图1所示)中,若向某一电解质溶液中逐滴加另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮(如图2)的是___________ (填字母)。
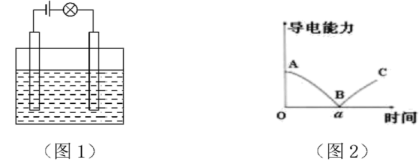
| A.盐酸中逐滴加入食盐溶液 |
| B.硫酸中逐滴加入氢氧化钠溶液 |
| C.石灰乳中滴加稀盐酸 |
| D.硫酸中逐滴加入氢氧化钡溶液 |
(5)试推测“硫酸中逐滴加入氢氧化钠溶液”,灯泡亮度的变化:
(6)某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论中,正确的是___________
图A
 图B
图B
| A.硝酸钾固体不是电解质 |
| B.硝酸钾溶液是电解质 |
| C.硝酸钾在水溶液中电离出了可以自由移动的离子 |
| D.在硝酸钾溶液中,水电离出了大量的离子 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】将0.100molAgCl加入到浓度为1.20mol·L-1的1.00L氨水中[Ksp(AgCl)=10-9.75,Ag(NH3)生成常数β2=107.05]。
(1)计算AgCl沉淀溶解反应的平衡常数K值___ 。
(2)判断0.100molAgCl能否全部溶解___ ?
(3)计算溶液中Ag+的游离浓度为多少mol·L-1___ (假设体积不变)
(1)计算AgCl沉淀溶解反应的平衡常数K值
(2)判断0.100molAgCl能否全部溶解
(3)计算溶液中Ag+的游离浓度为多少mol·L-1
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】农业生产离不开空气、水、土壤和肥料,保护土壤资源,防止土壤污染,改良土壤酸碱性是保证社会可持续发展的重要工作。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:_______ 。
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。_______ ;_______ 。
(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):_______ 。
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):_______ 。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中
 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】利用烧结的铁碳混合材料可除去废水中的污染物,在有、无溶解氧的情况下均可在溶液中生成絮凝剂,实现高效工作,其作用原理图示如下:
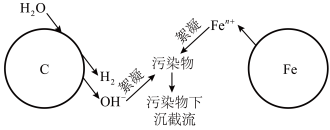
请回答:
(1)写出铁电极上电极方程式_________ 。
(2)下列叙述正确的是。
(3)有溶解氧时絮凝过程是利用了铁离子水解产物吸附污染物完成截流,写出相关的离子方程式_______ 。
(4)无溶解氧时,可以利用生成的絮凝剂处理含铬废水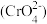 ,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为
,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为________ (以铬元素的量计算)。

请回答:
(1)写出铁电极上电极方程式
(2)下列叙述正确的是。
| A.铁电极为正极,碳电极为负极 |
| B.经过加热烧结的铁碳混合物表面空隙发达,吸附能力大幅提高,有利除污 |
| C.碳电极上的反应环境为无溶解氧环境 |
| D.铁碳混合材料工作过程中电子从铁电极流出,被絮凝剂运输至碳电极表面 |
(4)无溶解氧时,可以利用生成的絮凝剂处理含铬废水
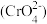 ,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为
,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】化学电池不仅可以作为电源将化学能转化为电能,还可以通过对电池电动势的测定求出电池反应的平衡常数。例如,将酸碱中和反应作为电池反应,可以设计出相应的电池,并由其电动势求出中和反应平衡常数及水的离子积。现将两个氢电极(以Pt 作为导电的惰性金属,以氢气作为参与电极反应的物质,可以是生成氢气,也可以是消耗氢气)分别置于酸性水溶液( H+)和碱性水溶液(OH-)中构成电池,使电池反应为酸碱中和反应。
(1)酸溶液中的氢电极A和碱溶液中的氢电极B,为电池正极是___________ (填 A或B) ;
(2)A, B上分别发生的电极反应为:A极:___________ ;B极:___________ ;
(3)总反应式为___________ ,该反应的平衡常数K与水的离子积Kw的关系是___________ 。
(1)酸溶液中的氢电极A和碱溶液中的氢电极B,为电池正极是
(2)A, B上分别发生的电极反应为:A极:
(3)总反应式为
您最近一年使用:0次



