第21届(2008年1月)全国高中学生化学竞赛(决赛)理论试题
全国
高三
竞赛
2021-07-09
181次
整体难度:
较难
考查范围:
竞赛、化学实验基础、有机化学基础
第21届(2008年1月)全国高中学生化学竞赛(决赛)理论试题
全国
高三
竞赛
2021-07-09
181次
整体难度:
较难
考查范围:
竞赛、化学实验基础、有机化学基础
一、填空题 添加题型下试题
填空题
|
较难(0.4)
1. 叠氮化合物不仅是重要的化工原料,也是良好的炸药和火箭推进剂,在国防和工业生产中有着广泛的应用。
(1)HN3分子的几何构型为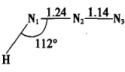 (图中键长单位为10-10m)。N-N、N=N和N≡N的共价键键长分别为1.40×10-10、1.20×10-10和1.09×10-10m,试画出HN3分子的共轭结构式
(图中键长单位为10-10m)。N-N、N=N和N≡N的共价键键长分别为1.40×10-10、1.20×10-10和1.09×10-10m,试画出HN3分子的共轭结构式________ 。
(2)叠氮有机铝化合物是多种叠氯化反应的试剂。在室温下,将一定量NaN3、苯和Et2AlCl混合,剧烈搅拌反应24h,常压蒸除溶剂,减压蒸馏得到叠氮二乙基铝(Et2AlN3,缩写DEAA)。在低温下,Et2AlCl形成稳定的二聚体,DEAA则形成稳定的三聚体。在上述聚合体中Al原子都是4配位,而且乙基的化学环境相同。试画出Et2AlCl二聚体和DEAA三聚体的结构式_________ 。
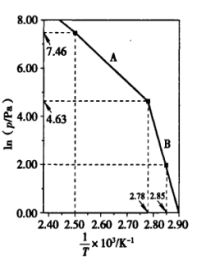
(3)DEAA的饱和蒸气压与温度的关系曲线如图所示。试计算反应 (DEAA)3(l)⇌DEAA(l)的摩尔焓变
(DEAA)3(l)⇌DEAA(l)的摩尔焓变____ 。
(4)取浓度为0.100mol·L-1DEAA的苯溶液,用凝固点下降法测得溶质的平均相对分子质量为372(DEAA三聚体的相对分子质量为381),试计算(DEAA)3在该溶液中的解离率_____ 。
(5)叠氮桥配合物不仅表现出多样化的桥联方式和聚合结构,在分子基磁性材料研究中极具价值。试画出叠氮桥联形成的双核配合物中叠氮根作桥联配体的各种可能方式(用M表示金属离子)_______ 。
(1)HN3分子的几何构型为
 (图中键长单位为10-10m)。N-N、N=N和N≡N的共价键键长分别为1.40×10-10、1.20×10-10和1.09×10-10m,试画出HN3分子的共轭结构式
(图中键长单位为10-10m)。N-N、N=N和N≡N的共价键键长分别为1.40×10-10、1.20×10-10和1.09×10-10m,试画出HN3分子的共轭结构式(2)叠氮有机铝化合物是多种叠氯化反应的试剂。在室温下,将一定量NaN3、苯和Et2AlCl混合,剧烈搅拌反应24h,常压蒸除溶剂,减压蒸馏得到叠氮二乙基铝(Et2AlN3,缩写DEAA)。在低温下,Et2AlCl形成稳定的二聚体,DEAA则形成稳定的三聚体。在上述聚合体中Al原子都是4配位,而且乙基的化学环境相同。试画出Et2AlCl二聚体和DEAA三聚体的结构式
(3)DEAA的饱和蒸气压与温度的关系曲线如图所示。试计算反应
 (DEAA)3(l)⇌DEAA(l)的摩尔焓变
(DEAA)3(l)⇌DEAA(l)的摩尔焓变
(4)取浓度为0.100mol·L-1DEAA的苯溶液,用凝固点下降法测得溶质的平均相对分子质量为372(DEAA三聚体的相对分子质量为381),试计算(DEAA)3在该溶液中的解离率
(5)叠氮桥配合物不仅表现出多样化的桥联方式和聚合结构,在分子基磁性材料研究中极具价值。试画出叠氮桥联形成的双核配合物中叠氮根作桥联配体的各种可能方式(用M表示金属离子)
您最近一年使用:0次
填空题
|
适中(0.65)
2. 高铁酸钾(K2FeO4)是一种新型选择性氧化剂和超铁电池的正极材料,在水处理、有机合成、电池工业等方面展现出广阔的应用前景。早在1951年,Thompson等已成功地利用化学方法合成了纯度为97%~99%的K2FeO4。已知相关物质的标准电极电势如下:
 +8H++3e-→Fe3++4H2O
+8H++3e-→Fe3++4H2O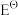 =2.20V
=2.20V
 +4H2O+3e-→Fe(OH)3+5OH-
+4H2O+3e-→Fe(OH)3+5OH-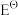 =0.72V
=0.72V
2HClO+2H++2e-→Cl2+2H2O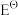 =1.611V。
=1.611V。
ClO-+H2O+2e-→Cl-+2OH-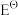 =0.81V
=0.81V
Cl2+2e-→2Cl-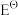 =1.358V
=1.358V
(1)试写出以Fe(NO3)3为铁源、KClO为氧化剂,在KOH溶液中制备K2FeO4的离子方程式_______ 。
(2)研究发现,Fe(OH)3能催化溶液中K2FeO4的分解。在相同条件下,分别以Fe(NO3)3和K3[FeF6]为原料制备K2FeO4,哪种铁源制备K2FeO4的产率较高______ ?简述理由_______ 。
(3)高铁酸在水溶液中有4种形体,其酸常数为pKa1=1.6、pKa2=3.5、pKa3=7.3.pH=1.0的该溶液4种形体中哪2种是主要的?写出它们的化学式_______ 。
(4)K2FeO4在KOH溶液中可将甲苯氧化成苯甲醛, 转化为红棕色沉淀和绿色溶液(绿色是由
转化为红棕色沉淀和绿色溶液(绿色是由 呈现的),该绿色溶液与适量S2-发生氧化还原反应生成深色沉淀,组成分析发现该沉淀为3种物质的混合物,写出它们的化学式
呈现的),该绿色溶液与适量S2-发生氧化还原反应生成深色沉淀,组成分析发现该沉淀为3种物质的混合物,写出它们的化学式________ 。
(5)以K2FeO4作为锂离子电池的正极材料,可嵌入/脱嵌Li+离子。1.00gK2FeO4的理论容量为406mAh,请通过计算写出K2FeO4可逆嵌入/脱嵌Li+的方程式__________ 。
 +8H++3e-→Fe3++4H2O
+8H++3e-→Fe3++4H2O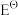 =2.20V
=2.20V +4H2O+3e-→Fe(OH)3+5OH-
+4H2O+3e-→Fe(OH)3+5OH-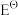 =0.72V
=0.72V2HClO+2H++2e-→Cl2+2H2O
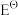 =1.611V。
=1.611V。ClO-+H2O+2e-→Cl-+2OH-
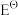 =0.81V
=0.81VCl2+2e-→2Cl-
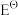 =1.358V
=1.358V(1)试写出以Fe(NO3)3为铁源、KClO为氧化剂,在KOH溶液中制备K2FeO4的离子方程式
(2)研究发现,Fe(OH)3能催化溶液中K2FeO4的分解。在相同条件下,分别以Fe(NO3)3和K3[FeF6]为原料制备K2FeO4,哪种铁源制备K2FeO4的产率较高
(3)高铁酸在水溶液中有4种形体,其酸常数为pKa1=1.6、pKa2=3.5、pKa3=7.3.pH=1.0的该溶液4种形体中哪2种是主要的?写出它们的化学式
(4)K2FeO4在KOH溶液中可将甲苯氧化成苯甲醛,
 转化为红棕色沉淀和绿色溶液(绿色是由
转化为红棕色沉淀和绿色溶液(绿色是由 呈现的),该绿色溶液与适量S2-发生氧化还原反应生成深色沉淀,组成分析发现该沉淀为3种物质的混合物,写出它们的化学式
呈现的),该绿色溶液与适量S2-发生氧化还原反应生成深色沉淀,组成分析发现该沉淀为3种物质的混合物,写出它们的化学式(5)以K2FeO4作为锂离子电池的正极材料,可嵌入/脱嵌Li+离子。1.00gK2FeO4的理论容量为406mAh,请通过计算写出K2FeO4可逆嵌入/脱嵌Li+的方程式
【知识点】 酸碱理论和水溶液中的离子平衡 电化学
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
解题方法
3. 近年来人们开发了一种由铝合金和硼纤维组成的铝合金基-硼纤维复合材料。该材料具有比铝合金更高的比强度和比模量,可用于航空、航天飞行器。有人设计了一种分析这种复合材料中硼含量的方法:用混酸溶解m克样品,配成体积为V0的试样溶液;通过强酸型阳离子交换树脂除尽溶液中的金属阳离子;以甲基红为指示剂,用NaOH溶液中和试样溶液;加入甘露醇,使硼酸(Ka=5.8×10-10)定量地转变为甘露醇-硼酸配合物(Ka=8.4×10-6),反应方程式为:
 +H3BO3=
+H3BO3=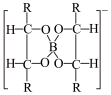 +H++3H2O
+H++3H2O
再加入适当指示剂,用NaOH溶液滴定到终点。主要分析流程图如下(图中只列出主要物质,其他少量物质的干扰可以不予考虑)。

(1)写出从A框到B框生成H3BO3的反应方程式以及H3BO3在水溶液中的电离方程式___ 、___ 。
(2)除去过量酸后的热溶液在冷却至室温过程中有时析出白色鳞片状晶体。写出该晶体的化学式并解释为什么晶体呈片状_____ 、_____ 。
(3)从C框到D框的滴定操作过程中,是否需要准确地中和H+____ ?简述原因_____ 。
(4)从原理上分析D框到E框这一步操作的目的______ 。
(5)如果E框中配合物和NaOH滴定剂的浓度均为0.10mol·L-1,请估算滴定到化学计量点时的pH___ ,并指出从E框到F框的滴定过程中,应该选用哪种指示剂___ ?滴定终点的颜色是什么____ ?
(6)V0、V1和V2的单位都为mL,MB为硼的摩尔质量(g·mol-1),c(NaOH)为NaOH溶液的浓度(mol·L-1),请给出被测溶液中硼含量(g·L-1)的计算式________ 。
 +H3BO3=
+H3BO3= +H++3H2O
+H++3H2O再加入适当指示剂,用NaOH溶液滴定到终点。主要分析流程图如下(图中只列出主要物质,其他少量物质的干扰可以不予考虑)。

(1)写出从A框到B框生成H3BO3的反应方程式以及H3BO3在水溶液中的电离方程式
(2)除去过量酸后的热溶液在冷却至室温过程中有时析出白色鳞片状晶体。写出该晶体的化学式并解释为什么晶体呈片状
(3)从C框到D框的滴定操作过程中,是否需要准确地中和H+
(4)从原理上分析D框到E框这一步操作的目的
(5)如果E框中配合物和NaOH滴定剂的浓度均为0.10mol·L-1,请估算滴定到化学计量点时的pH
| 指示剂 | 变色范围pH | 颜色 | pKHln | |
| 酸式 | 碱式 | |||
| 甲基橙 | 3.1~4.4 | 红 | 橙黄 | 3.4 |
| 甲基红 | 4.4~6.2 | 红 | 黄 | 5.0 |
| 酚红 | 6.7~8.4 | 黄 | 红 | 8.0 |
| 酚酞 | 8.2~10.0 | 无 | 紫红 | 9.4 |
【知识点】 物质含量的测定 酸碱理论和水溶液中的离子平衡
您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
解题方法
4. 1967年,C.J.Pedersen发表了关于冠醚合成和选择性配位碱金属离子的论文,开创了超分子化学新领域。超分子主要是指分子通过非共价键完成自我识别与自我组装过程形成的具有特定结构的分子聚集体。在超分子层次上,化学与生命环境、材料、信息等等学科相互交叉,形成超分子科学。目前,超分子科学在分子器件基因结构、纳米材料等方面取得了巨大进展,已成为21世纪一个十分活跃的前沿领域。近期化学家合成了一种结构非常特殊的超分子,其设计思路是,利用分子自我识别与自我组装的能力,将3个环状化合物套入Y型分子的骨架上,再通过化学反应将3个环状化合物的侧链进行关环形成第4个环。图示如下:
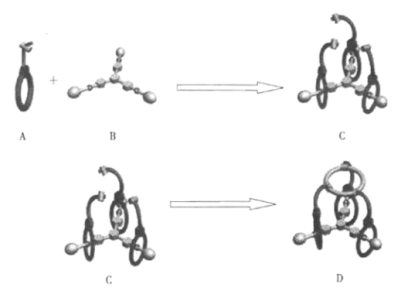
(1)已知化合物A.、B的结构分别如下图所示,试问:它们通过什么作用进行自我识别与自我组装__ ?

(2)在用邻苯二酚和1,8-二氯-3,6-二氧杂辛烷进行[2+2]环化合成化合物A中的大环冠醚部分时,需用到2种方法以提高成环产率,即高度稀释和加入金属离子(模板离子)。试说明为什么加入模板离子会提高产率____ ?对Na+、K+、Rb+、Cs+而言哪种离子作模板产率最高______ ?为什么________ ?
(3)将超分子C转变为D时使用的化学反应通常称之为烯烃复分解反应,生成D的同时,还生成另一种化合物E。已知D中的第4个环为三十三元环,试向化合物E是________ 。反应过程中每生成一个D同时生成_________ 个E。
(4)K是合成化合物A的原料之一,以E为主要原料合成K的路线如下,请写出F、G、H、I、J、K所代表的化合物或反应条件:F____ 、G____ 、H____ 、I___ 、J___ 、K___ 。
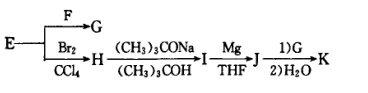
(5)K也可以用如下所示的路线合成,写出L、M、N、O所代表的化合物:L_____ 、M_____ 、N_____ 、O_____ 。


(1)已知化合物A.、B的结构分别如下图所示,试问:它们通过什么作用进行自我识别与自我组装

(2)在用邻苯二酚和1,8-二氯-3,6-二氧杂辛烷进行[2+2]环化合成化合物A中的大环冠醚部分时,需用到2种方法以提高成环产率,即高度稀释和加入金属离子(模板离子)。试说明为什么加入模板离子会提高产率
(3)将超分子C转变为D时使用的化学反应通常称之为烯烃复分解反应,生成D的同时,还生成另一种化合物E。已知D中的第4个环为三十三元环,试向化合物E是
(4)K是合成化合物A的原料之一,以E为主要原料合成K的路线如下,请写出F、G、H、I、J、K所代表的化合物或反应条件:F
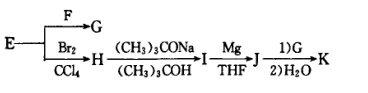
(5)K也可以用如下所示的路线合成,写出L、M、N、O所代表的化合物:L

您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
较难(0.4)
5. NO可经氮氧化物酶催化在生命过程中产生,并在此过程中起重要作用,但是,人们至今尚未探明NO参与代谢的细节。因此,发展能够在生物环境下实时检测NO的方法,成为摆在化学家、生物学家以及工程师们面前的课题。小分子荧光检测器在实时检测生物体内NO的领域具有良好的应用前景。最近,化学家合成了一组荧光分子(FL1~FL5),可用于生物体内NO的实时检测。先将荧光分子与CuCl2制成配合物,当体系中有NO出现时,NO与配合物相互作用,从中置换出铜(I),通过对比反应前后体系荧光光谱的变化,即可检测NO。原理示意(FL代表荧光配体):FL+Cu(II)⇌[Cu(II)Fl] Cu(I)+FL-NO,合成的荧光配体FL1见下图:
Cu(I)+FL-NO,合成的荧光配体FL1见下图:
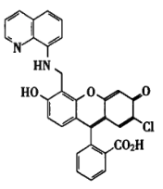
(1)已知FL1与CuCl2生成的配合物分子式为C30H18N2O5Cl2Cu,其中铜为4配位,试写出该配合物的结构式___________ 。
(2)NO与5-1的配合物作用,生成分子式为C30H18N3O6Cl的化合物和CuCl,试写出该化合物最可能的结构式____________ 。
(3)荧光分子FL5(C32H21N2O7Cl)的合成路线如下,请写出A、B、C、D、E以及FL5的结构式: A_____ 、B_____ 、C_____ 、D_____ 、E_____ 、FL5_____ 。
I.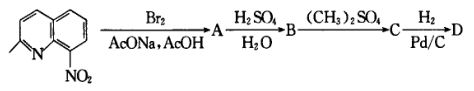
II.
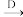 E
E FL5
FL5
 Cu(I)+FL-NO,合成的荧光配体FL1见下图:
Cu(I)+FL-NO,合成的荧光配体FL1见下图:
(1)已知FL1与CuCl2生成的配合物分子式为C30H18N2O5Cl2Cu,其中铜为4配位,试写出该配合物的结构式
(2)NO与5-1的配合物作用,生成分子式为C30H18N3O6Cl的化合物和CuCl,试写出该化合物最可能的结构式
(3)荧光分子FL5(C32H21N2O7Cl)的合成路线如下,请写出A、B、C、D、E以及FL5的结构式: A
I.
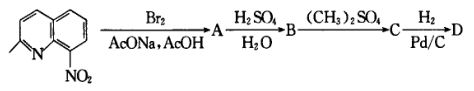
II.

 E
E FL5
FL5
【知识点】 分子结构
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-结构与性质
|
困难(0.15)
6. 2007年诺贝尔化学奖授予德国科学家G.Ertl,以表彰他在“固体表面化学过程”研究中做出的贡献。化学工业中广泛使用的负载型催化剂(主要由载体和表面活性组分组成)的制备科学,就是典型的固体表面化学过程的应用。例如,NiO/γ-Al2O3催化剂由γ-Al2O3载体和NiO活性组分组成。研究表明,γ-Al2O3中的O2-具有NaCl晶体中Cl-的堆积方式,γ-Al2O3的主要暴露面为C层或D层(如图1所示),它们的暴露机会均等,分布在该面上的O2-和Al3+如图2所示。
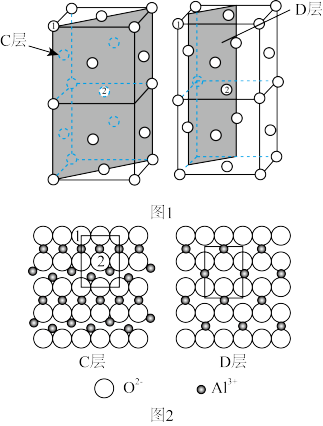
(1)在C层和D层的单位网格(即图2中的方框)内分别有几个处于由体相暴露出来的四面体空隙中的Al3+和八面体空隙中的Al3+_________ 、_______ ?
(2)NiO/γ-Al2O3催化剂中分散在表面的NiO的Ni2+进入能形成表面四面体配位和八面体配位的位置,且与Ni2+相伴的O2-按γ-Al2O3堆积方式外延(假定只形成“单分子层”),请问在C层和D层的单位网格中各能容纳___________ 个Ni2+?
(3)将NiO换为CuO,文献报道Cu2+只能存在于表面的八面体空隙中,如果用氢还原不同配位环境的铜(Cu2+→Cu°),请估计还原温度较低的表面Cu2+分布在C层还是D层中____ ?简述理由____ 。
(4)已知O2-离子半径为0.140nm,试估算CuO/γ-Al2O3催化剂中CuO在γ-Al2O3表面的最大单层分散值(以每100m2的γ-Al2O3载体表面单层分散多少毫摩尔的CuO表示)_____ 。
(5)CuO/γ-Al2O3催化剂可以用于CO的催化氧化:2CO(g)+O2(g)=2CO2(g)。若在p 、473K下,有2molCO(g)被完全催化氧化生成CO2(g),请计算此过程中的反应焓变
、473K下,有2molCO(g)被完全催化氧化生成CO2(g),请计算此过程中的反应焓变___________ 。
已知298K下的热力学数据: (CO,g)=-110.5kJ·mol-1,
(CO,g)=-110.5kJ·mol-1, (CO2,g)=-393.5kJ·mol-1,在温度T=298~500K范围内热容Cp,m(CO,g)=29.556J·K-1·mol-1,Cp,m(O2,g)=29.526J·K-1·mol-1,Cp,m(CO2,g)=27.437J·K-1·mol-1。
(CO2,g)=-393.5kJ·mol-1,在温度T=298~500K范围内热容Cp,m(CO,g)=29.556J·K-1·mol-1,Cp,m(O2,g)=29.526J·K-1·mol-1,Cp,m(CO2,g)=27.437J·K-1·mol-1。
(6)CO的低温催化消除通常采用以γ-Al2O3为载体的负载型催化剂,人们对其反应机理已经有了较深入的研究。实验结果表明,CO在催化剂表面与O2反应的可能历程如下:
(1)CO+M CO(ads)
CO(ads)
(2)O2+2M 2O(ads)
2O(ads)
(3)CO(ads)+O(ads)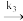 CO2(ads)+M
CO2(ads)+M
(4)CO2(ads) CO2+M
CO2+M
式中M为表面活性位,在该实验条件下M的数量为定值,下标ads表示吸附态。请用稳态近似法推导其速率方程,速率用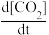 表示
表示____________ 。

(1)在C层和D层的单位网格(即图2中的方框)内分别有几个处于由体相暴露出来的四面体空隙中的Al3+和八面体空隙中的Al3+
(2)NiO/γ-Al2O3催化剂中分散在表面的NiO的Ni2+进入能形成表面四面体配位和八面体配位的位置,且与Ni2+相伴的O2-按γ-Al2O3堆积方式外延(假定只形成“单分子层”),请问在C层和D层的单位网格中各能容纳
(3)将NiO换为CuO,文献报道Cu2+只能存在于表面的八面体空隙中,如果用氢还原不同配位环境的铜(Cu2+→Cu°),请估计还原温度较低的表面Cu2+分布在C层还是D层中
(4)已知O2-离子半径为0.140nm,试估算CuO/γ-Al2O3催化剂中CuO在γ-Al2O3表面的最大单层分散值(以每100m2的γ-Al2O3载体表面单层分散多少毫摩尔的CuO表示)
(5)CuO/γ-Al2O3催化剂可以用于CO的催化氧化:2CO(g)+O2(g)=2CO2(g)。若在p
 、473K下,有2molCO(g)被完全催化氧化生成CO2(g),请计算此过程中的反应焓变
、473K下,有2molCO(g)被完全催化氧化生成CO2(g),请计算此过程中的反应焓变已知298K下的热力学数据:
 (CO,g)=-110.5kJ·mol-1,
(CO,g)=-110.5kJ·mol-1, (CO2,g)=-393.5kJ·mol-1,在温度T=298~500K范围内热容Cp,m(CO,g)=29.556J·K-1·mol-1,Cp,m(O2,g)=29.526J·K-1·mol-1,Cp,m(CO2,g)=27.437J·K-1·mol-1。
(CO2,g)=-393.5kJ·mol-1,在温度T=298~500K范围内热容Cp,m(CO,g)=29.556J·K-1·mol-1,Cp,m(O2,g)=29.526J·K-1·mol-1,Cp,m(CO2,g)=27.437J·K-1·mol-1。(6)CO的低温催化消除通常采用以γ-Al2O3为载体的负载型催化剂,人们对其反应机理已经有了较深入的研究。实验结果表明,CO在催化剂表面与O2反应的可能历程如下:
(1)CO+M
 CO(ads)
CO(ads)(2)O2+2M
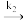 2O(ads)
2O(ads)(3)CO(ads)+O(ads)
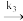 CO2(ads)+M
CO2(ads)+M(4)CO2(ads)
 CO2+M
CO2+M式中M为表面活性位,在该实验条件下M的数量为定值,下标ads表示吸附态。请用稳态近似法推导其速率方程,速率用
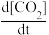 表示
表示
您最近一年使用:0次
五、填空题 添加题型下试题
填空题
|
适中(0.65)
7. 过渡金属大环配合物可以用作模拟金属酶的活性中心,其中Cu(I)配合物因可活化O2等小分子而倍受关注。最近有人在空气中以间苯二甲醛和三(3-氨丙基)胺(缩写为trpn)在Ag+离子存在下通过胺醛缩合生成Ag(I)席夫碱大环配合物1,并对其中氧原子的来源进行了研究,相关合成路线如下(图中未标出银的配位键):

(1)将纯化所得产物做了元素分析和红外光谱等基本表征,化合物的官能团在红外光谱上产生不同的特征吸收峰,如何利用配合物1的红外光谱判断产物中不含原料及低分子量的线性聚合物类的副产物____ ?
(2)在氩气氛中得到了配合物3,将配合物1和3在氩气氛中用足量的NaBH4还原,得到化合物4和5,并进行了红外光谱研究。请推测化合物4和5红外光谱上最主要的差别是______ ?
(3)测定了配合物1和3的晶体结构,结果发现配合物3中无氧,配合物1中和O原子相连的C原子的相关结构数据为:C-O键长为150.0pm、C-N键长为124.7pm,N-C-O、C-C-O和N-C-C的键角分别为126.0°,112.5°和121.5°,如何利用这些数据说明在空气中得到的确实是配合物1,而不是由于H2O分子在C=N双键上的加成所得到的配合物2______ ?
(4)在盐酸存在下将配合物1和3水解,过滤,滤液经分离除去trpn后的剩余组分经高效液相色谱分析,配合物1的水解产物色谱图上显示有A和B两个组分,代表纯组分相对量的峰面积比为33.02:66.09(A:B),而配合物3的水解产物仅有一种组分C.对A和B进行了质谱表征,其电喷雾质谱图分别为(a)和(b)(质谱图的纵坐标为相对丰度,横坐标为质荷比,相对丰度100%的峰对应的质荷比为M+1)。
说明A、B和C各为何物:A____ 、B____ 、C_____ 。
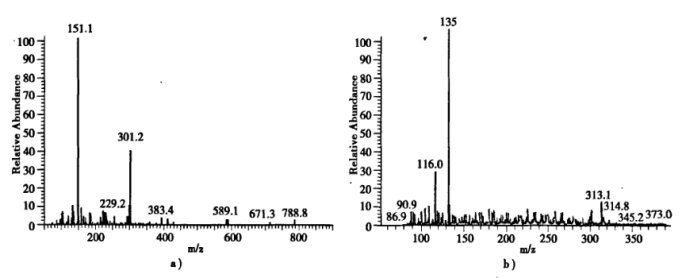
(5)在无trpn,其他条件和合成配合物1相同时,AgNO3在空气中不能氧化间苯二甲醛。对配合物进行氢核磁共振实验,所得谱图如下(图中不同位置的信号表示氢的化学环境不同),其中(a)图对应配合物1,(b)图对应无氧条件下新鲜制备的配合物3,(c)图对应配合物3在空气中放置-周后所得样品。结合前面几步的实验能否判断配合物1中氧原子的来源_________ ?请简述理由___________ 。

(1)将纯化所得产物做了元素分析和红外光谱等基本表征,化合物的官能团在红外光谱上产生不同的特征吸收峰,如何利用配合物1的红外光谱判断产物中不含原料及低分子量的线性聚合物类的副产物
(2)在氩气氛中得到了配合物3,将配合物1和3在氩气氛中用足量的NaBH4还原,得到化合物4和5,并进行了红外光谱研究。请推测化合物4和5红外光谱上最主要的差别是
(3)测定了配合物1和3的晶体结构,结果发现配合物3中无氧,配合物1中和O原子相连的C原子的相关结构数据为:C-O键长为150.0pm、C-N键长为124.7pm,N-C-O、C-C-O和N-C-C的键角分别为126.0°,112.5°和121.5°,如何利用这些数据说明在空气中得到的确实是配合物1,而不是由于H2O分子在C=N双键上的加成所得到的配合物2
(4)在盐酸存在下将配合物1和3水解,过滤,滤液经分离除去trpn后的剩余组分经高效液相色谱分析,配合物1的水解产物色谱图上显示有A和B两个组分,代表纯组分相对量的峰面积比为33.02:66.09(A:B),而配合物3的水解产物仅有一种组分C.对A和B进行了质谱表征,其电喷雾质谱图分别为(a)和(b)(质谱图的纵坐标为相对丰度,横坐标为质荷比,相对丰度100%的峰对应的质荷比为M+1)。

说明A、B和C各为何物:A
(5)在无trpn,其他条件和合成配合物1相同时,AgNO3在空气中不能氧化间苯二甲醛。对配合物进行氢核磁共振实验,所得谱图如下(图中不同位置的信号表示氢的化学环境不同),其中(a)图对应配合物1,(b)图对应无氧条件下新鲜制备的配合物3,(c)图对应配合物3在空气中放置-周后所得样品。结合前面几步的实验能否判断配合物1中氧原子的来源

【知识点】 分子结构
您最近一年使用:0次
试卷分析
整体难度:较难
考查范围:竞赛、化学实验基础、有机化学基础
试卷题型(共 7题)
题型
数量
填空题
4
解答题
3
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、填空题 | |||
| 1 | 0.4 | 分子结构 化学热力学初步 | |
| 2 | 0.65 | 酸碱理论和水溶液中的离子平衡 电化学 | |
| 5 | 0.4 | 分子结构 | |
| 7 | 0.65 | 分子结构 | |
| 二、解答题 | |||
| 3 | 0.4 | 物质含量的测定 酸碱理论和水溶液中的离子平衡 | 实验探究题 |
| 4 | 0.4 | 乙烯分子的组成 乙醇催化氧化 有机物的推断 化学动力学初步 | 有机推断题 |
| 6 | 0.15 | 晶体 化学热力学初步 化学动力学初步 | 结构与性质 |



