农业生产离不开空气、水、土壤和肥料,保护土壤资源,防止土壤污染,改良土壤酸碱性是保证社会可持续发展的重要工作。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:_______ 。
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。_______ ;_______ 。
(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):_______ 。
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):_______ 。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中
 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):
2012高二·浙江·竞赛 查看更多[1]
更新时间:2021-08-03 22:27:27
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氨的氧化物的治理是环境保护重要举措。
回答下列问题:
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:___________ ,该反应中氧化剂是___________ ,还原剂是___________ 。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________ 。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
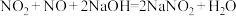
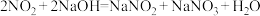
现有VL某NaOH溶液能完全吸收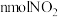 和
和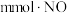 组成的大气污染物。
组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为___________  。
。
②若所得溶液中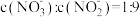 ,则原混合气体中
,则原混合气体中 和NO的物质的量之比
和NO的物质的量之比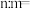
___________ 。
回答下列问题:
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
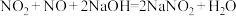
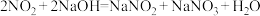
现有VL某NaOH溶液能完全吸收
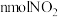 和
和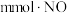 组成的大气污染物。
组成的大气污染物。①所用烧碱溶液的物质的量浓度至少为
 。
。②若所得溶液中
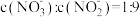 ,则原混合气体中
,则原混合气体中 和NO的物质的量之比
和NO的物质的量之比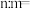
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】按要求回答下列问题:
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有___________ (填字母,下同),属于酸性氧化物的有___________ 。
②Fe2(SO4)3溶于水的电离方程式为___________ 。
③写出实验室制取Fe(OH)3胶体的离子方程式:___________ 。
④写出H与足量A反应的离子方程式:___________ 。
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:___________ 。

②该反应中的还原剂为___________ (填化学式),被还原的物质与被氧化的物质的物质的量之比为___________ 。
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=___________ 。
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有
②Fe2(SO4)3溶于水的电离方程式为
③写出实验室制取Fe(OH)3胶体的离子方程式:
④写出H与足量A反应的离子方程式:
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:

②该反应中的还原剂为
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为
 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②Na2FeO2+□NaNO2+□H2O →□Na2Fe2O4+□NH3↑+□NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
请回答下列问题
(1)配平化学方程式②,各物质前的化学计量数依次为___________________ 。
(2)上述反应①中还原剂为_______ ,被还原的是________ 。若有1mol Na2FeO2生成,则反应①中有 ________ mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是_________ (填字母)。
A.该过程不会产生污染 B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应 D.反应①②中的氧化剂均为NaNO2
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②Na2FeO2+□NaNO2+□H2O →□Na2Fe2O4+□NH3↑+□NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
请回答下列问题
(1)配平化学方程式②,各物质前的化学计量数依次为
(2)上述反应①中还原剂为
(3)关于形成“发蓝”的过程,下列说法正确的是
A.该过程不会产生污染 B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应 D.反应①②中的氧化剂均为NaNO2
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】请按要求填写下列方程式:
(1)请写出下列物质的电离方程式(分步的所有步都写):
NH3•H2O:___________
H2CO3:___________
(2)请写出下列盐的水解离子方程式(分步的所有步都写):
AlCl3:___________
CH3COONa:___________
Na2S:___________
(1)请写出下列物质的电离方程式(分步的所有步都写):
NH3•H2O:
H2CO3:
(2)请写出下列盐的水解离子方程式(分步的所有步都写):
AlCl3:
CH3COONa:
Na2S:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】CuSO4溶液是中学化学及农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是____________ 。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是_______ (填“ZnSO4”或“CuSO4”) 溶液; Cu极的电板反应式是_______ 。

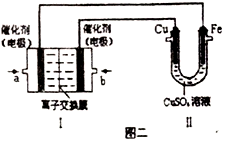
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a 处通入的是_______ (填“CH4”或“O2” ),a处电极上发生的电极反应式是_____________ 。若只把Ⅱ中电极均换为惰性电极,电解时的化学反应方程式为_____________________ 。若把Ⅱ中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体为672mL (标准状况下) 时,溶液的pH=_______ (假设电解后溶液体积不变)。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是


②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a 处通入的是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】消毒剂在生产、生活中有重要的作用,常见的含氯消毒剂有NaClO2、NaClO、ClO2 和Cl2
回答下列问题:
(1)NaClO2所含的化学键类型有________________ 。
(2)消毒剂投入水中,一段时间后与氨结合得到一种结合性氯胺(NH2Cl)。NH2Cl 在中性或酸性条件下也是一种强杀菌消毒剂,常用于城市自来水消毒。其理由是________________ (用化学方程式表示)。
(3) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克Cl2 的氧化能力。上述四种含氯消毒剂中消毒能力最强的是________________ 。
(4)自来水厂用ClO2 处理后的水中,要求ClO2 的浓度在0.1~0.8 mg·L-1之间。用碘量法检测ClO2 处理后的自来水中ClO2 浓度的实验步骤如下:
步骤Ⅰ.取一定体积的水样,加入足量碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。
步骤Ⅱ.用Na2S2O3 溶液滴定步骤Ⅰ中所得的溶液。
已知:a. 操作时,不同pH 环境中粒子种类如下表所示。
b. 2S2O32-+I2==S4O62-+2I-。
①步骤Ⅱ中反应结束时溶液呈___________ (填“蓝色”或“无色”)
②若水样的体积为1.0L,在步骤Ⅱ中消耗10mL1.0×10-3mol·L-1Na2S2O3 溶液,则该水样中c(ClO2)=___________ mg·L-1
回答下列问题:
(1)NaClO2所含的化学键类型有
(2)消毒剂投入水中,一段时间后与氨结合得到一种结合性氯胺(NH2Cl)。NH2Cl 在中性或酸性条件下也是一种强杀菌消毒剂,常用于城市自来水消毒。其理由是
(3) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克Cl2 的氧化能力。上述四种含氯消毒剂中消毒能力最强的是
(4)自来水厂用ClO2 处理后的水中,要求ClO2 的浓度在0.1~0.8 mg·L-1之间。用碘量法检测ClO2 处理后的自来水中ClO2 浓度的实验步骤如下:
步骤Ⅰ.取一定体积的水样,加入足量碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。
步骤Ⅱ.用Na2S2O3 溶液滴定步骤Ⅰ中所得的溶液。
已知:a. 操作时,不同pH 环境中粒子种类如下表所示。
| pH | 2 | 7 |
| 粒子种类 | Cl- | ClO2- |
b. 2S2O32-+I2==S4O62-+2I-。
①步骤Ⅱ中反应结束时溶液呈
②若水样的体积为1.0L,在步骤Ⅱ中消耗10mL1.0×10-3mol·L-1Na2S2O3 溶液,则该水样中c(ClO2)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】熟石灰在生产和生活中有广泛的用途。请回答:
(1)熟石灰中金属元素的原子结构示意图是_____ 。
(2)区分熟石灰溶液、氯化钠溶液、稀硫酸的操作及现象是__________ 。
(3)用石灰浆粉刷墙壁,干燥后墙面变硬,反应的化学方程式是_____ 。
(4)某地区土壤呈酸性(含硫酸),可选用熟石灰来改良,则反应的化学方程式是_________ 。
(5)用熟石灰粉与草木灰按一定比例混合可制得高效环保农药“黑白粉”。使用时,选择在有露 水的早晨,把“黑白粉”撒在植物茎叶上,可消除忌碱虫体。
①“黑白粉”比熟石灰更高效,是由于生成了碱性更强的物质,该反应的化学方程式是________ 。
②“黑白粉”中可提供植物生长和抗倒伏的营养元素是_____ (填元素符号)。
(1)熟石灰中金属元素的原子结构示意图是
(2)区分熟石灰溶液、氯化钠溶液、稀硫酸的操作及现象是
(3)用石灰浆粉刷墙壁,干燥后墙面变硬,反应的化学方程式是
(4)某地区土壤呈酸性(含硫酸),可选用熟石灰来改良,则反应的化学方程式是
(5)用熟石灰粉与草木灰按一定比例混合可制得高效环保农药“黑白粉”。使用时,选择在有露 水的早晨,把“黑白粉”撒在植物茎叶上,可消除忌碱虫体。
①“黑白粉”比熟石灰更高效,是由于生成了碱性更强的物质,该反应的化学方程式是
②“黑白粉”中可提供植物生长和抗倒伏的营养元素是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】我们认识的一些物质,在实际生活中有重要的用途。现有下列下列物质:A.Na2CO3 B.Ca(OH)2 C.CO(NH2)2D.HCl e.CO2 f.Ti-Al合金。请根据它们的用途,用字母代号填空:(1)______ 用于制造人造骨;(2)用于改造酸性土壤的是__________ ;(3)汽车制造厂电镀前用于金属表面除锈的是___________ ;(4)___________ 常用于制皂和厨房中用来洗去油污;;(5)__________ 是一种最重要的温室气体肥料。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】化学合成的成果常需要一定的时间才得以应用于日常生活。例如化合物A合成于1929 年,至1969年才被用作牙膏的添加剂和补牙填充剂成分,A是离子晶体,由NaF和NaPO3在熔融状态下反应得到,它易溶于水,阴离子水解产生氟离子和对人体无毒的另一种离子。
(1)写出合成A的反应方程式____ 。
(2)写出A中阴离子水解反应的离子方程式____ 。
(1)写出合成A的反应方程式
(2)写出A中阴离子水解反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】从某些性质看, NH3和H2O,NH 和H3O+,OH-和NH
和H3O+,OH-和NH ,NH
,NH 和O2-两两相似。
和O2-两两相似。
(1)试写出乙酸在液态氨中的形式_______ 。在水溶液中CH3COOH CH4+CO2,则乙酸在液态氨中的相应反应的方程式为
CH4+CO2,则乙酸在液态氨中的相应反应的方程式为_______ 。
(2)在液态氟化氢中,SbF5成为导电强的溶液,其离子方程式为_______ ,生成的两种物质的几何构型为_______ ,_______ 。
 和H3O+,OH-和NH
和H3O+,OH-和NH ,NH
,NH 和O2-两两相似。
和O2-两两相似。(1)试写出乙酸在液态氨中的形式
 CH4+CO2,则乙酸在液态氨中的相应反应的方程式为
CH4+CO2,则乙酸在液态氨中的相应反应的方程式为(2)在液态氟化氢中,SbF5成为导电强的溶液,其离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】称取0.8242g某固体一元弱酸HB,定容至250mL,此溶液恰好为饱和溶液。测得此溶液的pH=2.90,已知此一元酸的pKa=4.21。
(1)计算此固体酸的溶解度_______ mol·L-1,摩尔质量_______ 。
(2)计算此饱和溶液中酸根B-的分布分数_______ 。
(3)已知HB中只含有C、H、O三种元素,其中C的质量分数为68.85%,H为4.95%,O为26.21%,写出此固体酸的分子式_______ 。
(4)已知此固体酸含有苯环和Π ,画出它的结构简式
,画出它的结构简式_______ ;若将此酸溶于苯中,主要生成双分子结构,解释其原因_______ 。
(1)计算此固体酸的溶解度
(2)计算此饱和溶液中酸根B-的分布分数
(3)已知HB中只含有C、H、O三种元素,其中C的质量分数为68.85%,H为4.95%,O为26.21%,写出此固体酸的分子式
(4)已知此固体酸含有苯环和Π
 ,画出它的结构简式
,画出它的结构简式
您最近一年使用:0次



