CuSO4溶液是中学化学及农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是____________ 。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
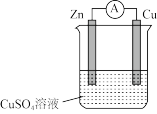
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是_______ (填“ZnSO4”或“CuSO4”) 溶液; Cu极的电板反应式是_______ 。

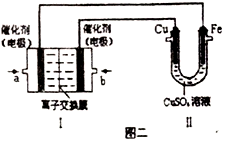
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a 处通入的是_______ (填“CH4”或“O2” ),a处电极上发生的电极反应式是_____________ 。若只把Ⅱ中电极均换为惰性电极,电解时的化学反应方程式为_____________________ 。若把Ⅱ中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体为672mL (标准状况下) 时,溶液的pH=_______ (假设电解后溶液体积不变)。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是


②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a 处通入的是
更新时间:2018-03-16 17:46:05
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】某二元酸(化学式用H2B表示)在水中的电离方程式如下:H2B=H++HB−、HB−⇌H++B2−,回答下列问题:
(1)Na2B溶液显____ (填“酸性”“中性”或“碱性”),理由是___ (用离子方程式表示)。
(2)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是_____ 。
A.c(B2−)+c(HB−)+c(H2B)=0.1mol/L
B.c(Na+)+c(OH−)=c(H+)+c(HB−)
C.c(Na+)+c(H+)=c(OH−)+c(HB−)+2c(B2−)
D.c(Na+)=2c(B2−)+2c(HB−)
(3)已知0.1mol/LNaHB溶液的pH=2,则0.1mol/LH2B溶液中氢离子的物质的量浓度可能是___ 0.11mol/L(填“<”“>”或“=”)。
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是____ 。
(1)Na2B溶液显
(2)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2−)+c(HB−)+c(H2B)=0.1mol/L
B.c(Na+)+c(OH−)=c(H+)+c(HB−)
C.c(Na+)+c(H+)=c(OH−)+c(HB−)+2c(B2−)
D.c(Na+)=2c(B2−)+2c(HB−)
(3)已知0.1mol/LNaHB溶液的pH=2,则0.1mol/LH2B溶液中氢离子的物质的量浓度可能是
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】按要求完成下列填空:
(1)泡沫灭火器所用的原料为硫酸铝和碳酸氢钠,用离子方程式表示泡沫灭火器的灭火原理__________ 。
(2)向含有 Mg(OH)2 固体的浊液中加入浓 NH4Cl 溶液,Mg(OH)2 固体溶解,用化学方程式解释原因___________ 。
(3)浓度均为 1 mol/L 的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2 三种溶液中,测得其中 c(NH )分别为amol/L、b mol/L、c mol/L,则 a、b、c 由大到小的顺序为
)分别为amol/L、b mol/L、c mol/L,则 a、b、c 由大到小的顺序为___________ 。
(4)实验室制备无水 CuCl2 时,在 Cu(OH)2 中加入盐酸使 Cu(OH)2 转化为 CuCl2,采用稍过量盐酸和低温蒸干的目的是___________ 。
(1)泡沫灭火器所用的原料为硫酸铝和碳酸氢钠,用离子方程式表示泡沫灭火器的灭火原理
(2)向含有 Mg(OH)2 固体的浊液中加入浓 NH4Cl 溶液,Mg(OH)2 固体溶解,用化学方程式解释原因
(3)浓度均为 1 mol/L 的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2 三种溶液中,测得其中 c(NH
 )分别为amol/L、b mol/L、c mol/L,则 a、b、c 由大到小的顺序为
)分别为amol/L、b mol/L、c mol/L,则 a、b、c 由大到小的顺序为(4)实验室制备无水 CuCl2 时,在 Cu(OH)2 中加入盐酸使 Cu(OH)2 转化为 CuCl2,采用稍过量盐酸和低温蒸干的目的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______ c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是________ (填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是__________ 。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______ ,溶液中c(CH3COO-)/c(CH3COOH) =________ 。
(2)某温度下, pH=3的盐酸中[OH-]=10-9 mol/L. 该温度下, pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为______ .
(3)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为_____ 。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=______ (写出准确数值)。
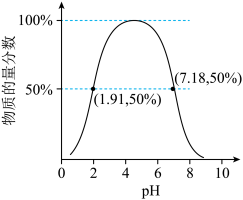
(4)在SO2溶于水形成的二元弱酸溶液中,含S元素的某微粒占所有含S元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为_______ ;该二元弱酸的一级电离常数为Ka1,则pKa1=-lgKa1≈____ 。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是
③将少量CO2通入NaCN溶液,反应的离子方程式是
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
(2)某温度下, pH=3的盐酸中[OH-]=10-9 mol/L. 该温度下, pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为
(3)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=
(4)在SO2溶于水形成的二元弱酸溶液中,含S元素的某微粒占所有含S元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】A、B、C三种强电解质,它们在水中电离出的离子为 、
、 、NO
、NO 、SO
、SO 、
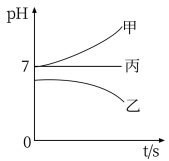
、 ,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8g。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8g。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:

(1)M为电源的___________ 极(填“正”或“负”),甲、乙两个烧杯中的电解质分别为___________ 、___________ (填写化学式)。
(2)计算电极f上生成气体的物质的量为___________ mol。此时丙烧杯加入___________ 克___________ 才能使丙中的溶液恢复到电解前的浓度。
(3)写出烧杯甲中a极电极反应式___________ ,b极电极反应式___________
(4)写出乙烧杯中的电解反应方程式:___________
 、
、 、NO
、NO 、SO
、SO 、
、 ,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8g。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8g。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:

(1)M为电源的
(2)计算电极f上生成气体的物质的量为
(3)写出烧杯甲中a极电极反应式
(4)写出乙烧杯中的电解反应方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题:
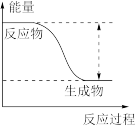
(1)反应Zn+CuSO4=ZnSO4+Cu的能量变化趋势如图所示:
①该反应为___________ 反应(填“吸热”或“放热”)。
②从能量变化的角度看,下列反应与该反应属于同一类型的是___________ 。
A.CaCO3 CO2↑+CaO B.2NaOH+H2SO4=Na2SO4+2H2O
CO2↑+CaO B.2NaOH+H2SO4=Na2SO4+2H2O
C.CO2+C 2CO D.NaHCO3+HCl=NaCl+CO2↑+H2O
2CO D.NaHCO3+HCl=NaCl+CO2↑+H2O
③某化学兴趣小组将Zn+CuSO4=ZnSO4+Cu设计成原电池(如图),该装置中电流的方向是____ (填“Zn→Cu”或“Cu→Zn”),电解质溶液为CuSO4,溶液中SO 移向电极
移向电极____ (填“Zn”或“Cu”),Cu电极的电极反应式为___________ 。若两电极质量相等,当电路中转移0.2mol电子后,两电极的质量差___________ g。
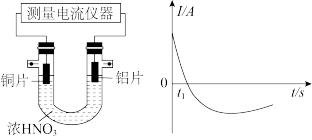
(2)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了如图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中t1时刻之前,Cu电极是______ (填“正极”或“负极”),t1时刻之后,正极反应式为_____ 。根据以上现象,最终得出结论:在原电池中,构成原电池的负极不一定是较活泼的金属材料。
(1)反应Zn+CuSO4=ZnSO4+Cu的能量变化趋势如图所示:

①该反应为
②从能量变化的角度看,下列反应与该反应属于同一类型的是
A.CaCO3
 CO2↑+CaO B.2NaOH+H2SO4=Na2SO4+2H2O
CO2↑+CaO B.2NaOH+H2SO4=Na2SO4+2H2OC.CO2+C
 2CO D.NaHCO3+HCl=NaCl+CO2↑+H2O
2CO D.NaHCO3+HCl=NaCl+CO2↑+H2O③某化学兴趣小组将Zn+CuSO4=ZnSO4+Cu设计成原电池(如图),该装置中电流的方向是
 移向电极
移向电极
(2)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了如图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中t1时刻之前,Cu电极是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】反应Fe+H2SO4 FeSO4+H2↑的能量变化趋势如图所示:
FeSO4+H2↑的能量变化趋势如图所示:
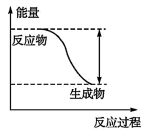
(1)该反应为____ (填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是____ (填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸
C.升高温度 D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____ (填“正”或“负”)极。铜片上产生的现象为_________ ,该极上发生的电极反应为_______________ ,外电路中电子由____ (填“正”或“负”,下同)极向____ 极移动。
 FeSO4+H2↑的能量变化趋势如图所示:
FeSO4+H2↑的能量变化趋势如图所示:
(1)该反应为
(2)若要使该反应的反应速率增大,下列措施可行的是
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸
C.升高温度 D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】按要求完成下列各题
(1)精炼铜时,阴极材料是__________ ,阴极的电极反应式是____________ ,
(2)氯碱工业电解饱和食盐水的总反应方程式为_____________________ 。
(3)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是__________
(4)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子。电池工作时正极反应式为________________ 。
若以该电池为电源,用石墨做电极电解100 mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________ mol。
(1)精炼铜时,阴极材料是
(2)氯碱工业电解饱和食盐水的总反应方程式为
(3)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
(4)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子。电池工作时正极反应式为
若以该电池为电源,用石墨做电极电解100 mL含有如下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO |
| c/(mol·L-1) | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】按要求回答下列问题:
(1)写出次氯酸的电子式:____________________________ 。
(2)用离子方程式表示碳酸钠溶液显碱性的原因:________________________ 。
(3)用离子方程式表示铝离子与偏铝酸根离子不能共存的原因:____________________________ 。
(4)用化学方程式表示1摩尔二氧化氮放置一段时间后分子数小于1摩尔的原因:___________________ 。
(5)碳酸镁不易溶于水,却能溶于氢氧化钠溶液,用化学方程式表示:_______________________ 。
(6)氯碱工业中,阳极的电极反应:____________________________ 。
(7)铅蓄电池放电时,负极反应:______________________________ 。
(8)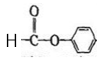 与氢氧化钠溶液共热的化学方程式:
与氢氧化钠溶液共热的化学方程式:________________________ 。
(1)写出次氯酸的电子式:
(2)用离子方程式表示碳酸钠溶液显碱性的原因:
(3)用离子方程式表示铝离子与偏铝酸根离子不能共存的原因:
(4)用化学方程式表示1摩尔二氧化氮放置一段时间后分子数小于1摩尔的原因:
(5)碳酸镁不易溶于水,却能溶于氢氧化钠溶液,用化学方程式表示:
(6)氯碱工业中,阳极的电极反应:
(7)铅蓄电池放电时,负极反应:
(8)
 与氢氧化钠溶液共热的化学方程式:
与氢氧化钠溶液共热的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】用硫酸处理红土镍矿时要消耗大量的硫酸,同时产生大量的硫酸钠及硫酸镁。为再生硫酸,科研人员利用电解食盐水的原理制取硫酸,装置如图。
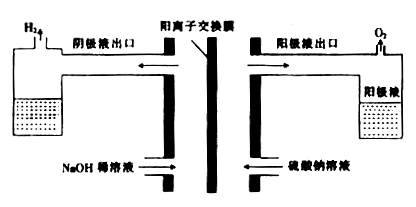
(1)电解时,阳极的电极反应式为____________________ ,电解过程中阴极周围溶液的PH______ (“增大”“减小”或“不变”)。
(2)硫酸镁销路不畅,而氢氧化镁较为畅销,获得氢氧化镁的方法是_____________________________ 。
(3)用电解原理也可处理含镍废水,同时还可回收金属镍,下图中①为__________ (填“阴”或“阳”)离子交换膜。阴极上Ni2+放电时的电极反应式为______________________________ 。


(1)电解时,阳极的电极反应式为
(2)硫酸镁销路不畅,而氢氧化镁较为畅销,获得氢氧化镁的方法是
(3)用电解原理也可处理含镍废水,同时还可回收金属镍,下图中①为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O请回答:
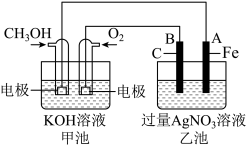
(1)甲池是_______ (填“原电池”或“电解池”),通入O2的电极作为_______ 极,该电极反应式为_______ 。
(2)乙池是_______ (填“原电池”或“电解池”),B电极名称为_______ 极,电极反应式为_______ 。
(3)甲池中溶液的pH_______ (填“增大”、“减小”或“不变”);乙池中溶液的pH_______ (填“增大”、“减小”或“不变”)。
(4)当乙池中A(Fe)极的质量增加5.40g时,电路中转移电子的物质的量是_______ mol,甲池中理论上消耗O2_______ mL(标准状况下)。

(1)甲池是
(2)乙池是
(3)甲池中溶液的pH
(4)当乙池中A(Fe)极的质量增加5.40g时,电路中转移电子的物质的量是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
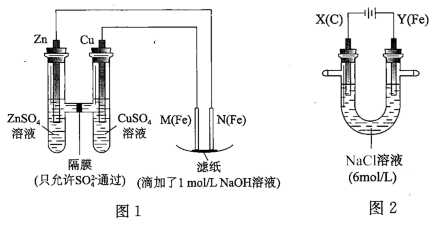
请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__ (填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__ 。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__ (填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____ g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__ 。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】用石墨电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。

(1)a电极是___________ 极,其中 移向
移向___________ 极(填a或b)。
(2)电解过程中,b电极的电极反应式:___________ 。
(3)电解过程中,a电极表面现象:___________ 。
(4)从P到Q点时收集到的混合气体的平均摩尔质量为___________ 。

(1)a电极是
 移向
移向(2)电解过程中,b电极的电极反应式:
(3)电解过程中,a电极表面现象:
(4)从P到Q点时收集到的混合气体的平均摩尔质量为
您最近一年使用:0次



