称取0.8242g某固体一元弱酸HB,定容至250mL,此溶液恰好为饱和溶液。测得此溶液的pH=2.90,已知此一元酸的pKa=4.21。
(1)计算此固体酸的溶解度_______ mol·L-1,摩尔质量_______ 。
(2)计算此饱和溶液中酸根B-的分布分数_______ 。
(3)已知HB中只含有C、H、O三种元素,其中C的质量分数为68.85%,H为4.95%,O为26.21%,写出此固体酸的分子式_______ 。
(4)已知此固体酸含有苯环和Π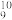 ,画出它的结构简式
,画出它的结构简式_______ ;若将此酸溶于苯中,主要生成双分子结构,解释其原因_______ 。
(1)计算此固体酸的溶解度
(2)计算此饱和溶液中酸根B-的分布分数
(3)已知HB中只含有C、H、O三种元素,其中C的质量分数为68.85%,H为4.95%,O为26.21%,写出此固体酸的分子式
(4)已知此固体酸含有苯环和Π
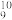 ,画出它的结构简式
,画出它的结构简式
更新时间:2021-08-17 21:39:36
|
【知识点】 酸碱理论和水溶液中的离子平衡
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】农业生产离不开空气、水、土壤和肥料,保护土壤资源,防止土壤污染,改良土壤酸碱性是保证社会可持续发展的重要工作。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:_______ 。
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。_______ ;_______ 。
(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):_______ 。
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):_______ 。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中
 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知溶液的导电性强弱由溶液中离子的浓度大小及离子所带电荷数决定。离子浓度越大,电荷数越多,则溶液导电性越强。某兴趣小组同学做了以下实验:

(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质 可以是
可以是___________ (填序号)。
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)上述物质中哪些是电解质___________ (填序号)。
(3)在电解质溶液的导电性实验装置(如图1所示)中,若向某一电解质溶液中逐滴加另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮(如图2)的是___________ (填字母)。
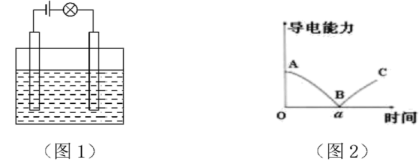
(4)写出上述实验中灯泡“由亮变暗,至熄灭”现象背后的离子反应方程式:___________ 。
(5)试推测“硫酸中逐滴加入氢氧化钠溶液”,灯泡亮度的变化:___________ ,变化的原因___________ (用离子方程式解释)。
(6)某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论中,正确的是___________
图A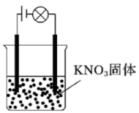 图B
图B

(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质
 可以是
可以是①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)上述物质中哪些是电解质
(3)在电解质溶液的导电性实验装置(如图1所示)中,若向某一电解质溶液中逐滴加另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮(如图2)的是___________ (填字母)。
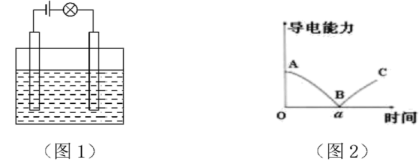
| A.盐酸中逐滴加入食盐溶液 |
| B.硫酸中逐滴加入氢氧化钠溶液 |
| C.石灰乳中滴加稀盐酸 |
| D.硫酸中逐滴加入氢氧化钡溶液 |
(5)试推测“硫酸中逐滴加入氢氧化钠溶液”,灯泡亮度的变化:
(6)某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论中,正确的是___________
图A
 图B
图B
| A.硝酸钾固体不是电解质 |
| B.硝酸钾溶液是电解质 |
| C.硝酸钾在水溶液中电离出了可以自由移动的离子 |
| D.在硝酸钾溶液中,水电离出了大量的离子 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】I.已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:醋酸:K=1.75×10-5;碳酸:K1=4.30×10-7 K2=5.61×10-11;亚硫酸:K1=1.54×10-2 K2=1.02×10-7。
(1)写出碳酸的第一级电离平衡常数表达式:K1=___ 。
(2)在相同条件下,试比较H2CO3、HCO 和HSO
和HSO 的酸性强弱: > > 。
的酸性强弱: > > 。___
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是___ (填序号)。
II.某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(4)你认为往废水中投入___ (填字母序号),沉淀效果最好。
(5)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1g·mL-1)。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)=___ 。[已知M(NaCl)=58.5,KSp(AgCl)=1.8×10-10mol2·L-2]。
(1)写出碳酸的第一级电离平衡常数表达式:K1=
(2)在相同条件下,试比较H2CO3、HCO
 和HSO
和HSO 的酸性强弱: > > 。
的酸性强弱: > > 。(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是
| A.c(CH3COO-) | B.c(H+) | C.醋酸电离平衡常数 | D.醋酸的电离程度 |
II.某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
您最近一年使用:0次



