锂离子电池已经成为新 一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe- =C6Li1-x +xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2 +xLi+ +xe- = LiMO2( LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是
负极反应:C6Li-xe- =C6Li1-x +xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2 +xLi+ +xe- = LiMO2( LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是
| A.锂离子电池充电时电池反应为C6Li +Li1-xMO2= LiMO2 +C6Li1-x |
| B.电池反应中,正极材料若分别用锂、锌、银、铅时,产生等量的电量,金属锂所消耗的质量最小 |
| C.锂离子电池放电时电池内部Li+向负极移动 |
| D.锂离子电池充电时阴极反应为C6L1-x+xLi+ +xe-= C6Li |
更新时间:2021-08-13 09:20:54
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】在合适的金属催化剂作用下,可以实现逆水煤气变换反应: CO2(g) + H2(g)⇌CO(g) +2H2O(g)。 反应的微观过程和相对能量(E)如下图所示,“*”代表在催化剂表面被吸附。
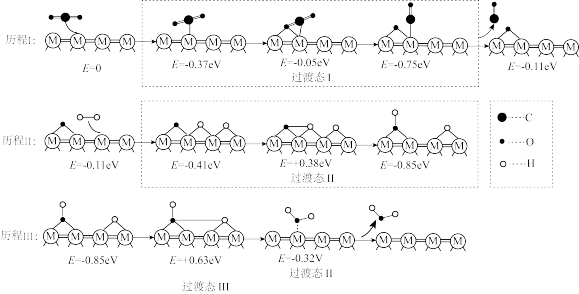
下列说法错误的是

下列说法错误的是
| A.历程I反应的方程式可表示为CO2(g)→CO(g) + O* |
| B.历程II涉及H- H的断裂和O- H的形成 |
| C.历程III决定了总反应的反应速率 |
| D.金属催化剂使整个反应的ΔH减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】化学反应的方向:对于可逆反应而言,有正向进行和逆向进行两个方向。一般地,判断反应方向有“焓判据”和“熵判据”两种判断方法。在此之前我们要先了解“熵”的概念。熵( )的定义式为
)的定义式为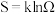 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):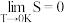
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能( ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: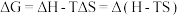
因此有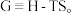 在压强与温度恒定时,若
在压强与温度恒定时,若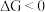 则正反应自发,若
则正反应自发,若 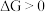 则逆反应自发,若
则逆反应自发,若 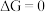 反应达到化学平衡。对于一个
反应达到化学平衡。对于一个 均为正的反应,下列可以使其正向进行的是
均为正的反应,下列可以使其正向进行的是
 )的定义式为
)的定义式为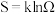 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):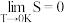
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能(
 ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: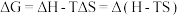
因此有
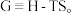 在压强与温度恒定时,若
在压强与温度恒定时,若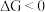 则正反应自发,若
则正反应自发,若 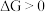 则逆反应自发,若
则逆反应自发,若 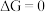 反应达到化学平衡。对于一个
反应达到化学平衡。对于一个 均为正的反应,下列可以使其正向进行的是
均为正的反应,下列可以使其正向进行的是| A.置于低温条件下 |
| B.置于高温条件下 |
| C.加入合适的催化剂 |
| D.将产物及时分离 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下。该电池反应产物分别是B和V最高价氧化物。下列说法正确的是
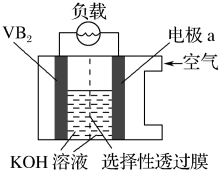

| A.反应过程中溶液的pH升高 |
| B.电池持续反应过程中,选择性透过膜只能用阳离子 选择性膜 |
| C.硼化钒属于原子晶体,电路通过1mole-时消耗硼化钒的质量为6.596g |
D.VB2极的电极反应式为:2VB2+2OH- -22e-=2VO +4B(OH) +4B(OH) +6H2O +6H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】锌空气电池驱动的汽车已用于公共交通,其电极总反应为2Zn + O2→2ZnO。下列说法中,不正确的是
| A.电极反应可通过空气流速控制 |
| B.可使用催化剂加速正极反应 |
| C.为了保存锌空气电池,应在电池负极贴上封条 |
| D.Zn是负极,电极反应为Zn + 2OH-→ZnO+H2O + 2e- |
您最近一年使用:0次

 和
和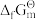 都为零
都为零

