应用电化学原理,回答下列问题。

(1)上述三个装置中,负极反应物化学性质上的共同特点是___________ 。
(2)甲中电流计指针偏移时,盐桥(装有含琼脂的KCl饱和溶液)中离子移动的方向是___________ 。
(3)乙中正极反应式为___________ ;若将H2换成CH4,则负极反应式为___________ 。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池___________ 极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。现连接如图装置并加入药品(盐桥中的物质不参与反应),进行实验:

ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U形管左侧逐渐加入浓Fe2(SO4)3溶液,发现电流表指针的变化依次为偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作___________ 极。
②综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是___________ 。

(1)上述三个装置中,负极反应物化学性质上的共同特点是
(2)甲中电流计指针偏移时,盐桥(装有含琼脂的KCl饱和溶液)中离子移动的方向是
(3)乙中正极反应式为
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。现连接如图装置并加入药品(盐桥中的物质不参与反应),进行实验:

ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U形管左侧逐渐加入浓Fe2(SO4)3溶液,发现电流表指针的变化依次为偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作
②综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是
17-18高二下·北京朝阳·期末 查看更多[9]
【全国区级联考】北京市朝阳区2017-2018学年高二下学期期末考试化学试题四川省雅安市2019-2020学年高二下学期期末考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第2节 化学能转化为电能——电池 课时1 原电池的工作原理高中必刷题高二选择性必修1第四章 化学反应与电能 第一节 原电池 课时1 原电池的工作原理(已下线)练习14 化学电源-2020-2021学年【补习教材·寒假作业】高二化学(人教版)(已下线)第16讲 原电池 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第16讲 原电池 新型电源 (练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题05 电化学原理的综合应用(一题多问)(已下线)第3讲 原电池 化学电源
更新时间:2021-08-18 12:06:44
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】A、B、C、D、X、Y六种物质之间有如图所示转化关系,请回答下列问题。
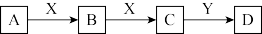
(1)若X是非金属单质O2,Y是H2O。
①当A为单质,则A不可能是___________ (填序号)。
a.Na b.Fe c.S d.N2
②当A为非金属氢化物,B是汽车尾气之一,遇空气变红棕色,则A→B的化学方程式为___________ ;将32 g铜与200 mL一定浓度的D溶液发生反应,铜完全溶解,产生B和C混合气体的体积为11.2L(标准状况),待产生的气体全部释放后,向溶液中加入500 mL 3.0 mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原D溶液的物质的量浓度为___________ mol/L。
(2)若X是金属单质Fe,Y是苛性钠,A在常温下是一种黄绿色气体,则A与C反应生成B的离子方程式为___________ ;向C溶液中加入Y溶液,可观察到的现象是___________ ;B溶液常用于蚀刻印刷电路铜板,若将该反应设计成原电池,负极电极反应式为___________ 。
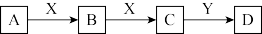
(1)若X是非金属单质O2,Y是H2O。
①当A为单质,则A不可能是
a.Na b.Fe c.S d.N2
②当A为非金属氢化物,B是汽车尾气之一,遇空气变红棕色,则A→B的化学方程式为
(2)若X是金属单质Fe,Y是苛性钠,A在常温下是一种黄绿色气体,则A与C反应生成B的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】(1)抽烟对人体有害,烟草不完全燃烧产生的CO被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生反应:CO+HbO2⇌O2+HbCO。实验表明,HbCO的浓度即使只有HbO2浓度的2%,也足以使人的智力受损。试回答:
①上述反应的平衡常数表达式为K=_____________________ 。
②抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。已知37℃时,平衡常数K=220,这时HbCO的浓度__________ HbO2浓度的0.02倍(填“大于”“等于”、或“小于”)。
(2)把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是________ 和__________ 。(填序号“I”“II”“III”或“IV”)

(3)一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g)

根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=___________ ,升高温度,K值 ________________ 。(填“增大”、“减小”或“不变”)。
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=_____________ 。
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是
,下列有关该体系的说法正确的是__________
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时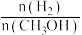 增大
增大
①上述反应的平衡常数表达式为K=
②抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。已知37℃时,平衡常数K=220,这时HbCO的浓度
(2)把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是

(3)一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g)

根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
 ,下列有关该体系的说法正确的是
,下列有关该体系的说法正确的是a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时
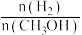 增大
增大
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:________________________________ 。
铁锈的主要成分是____________ (填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:_____________________ 。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。

①此装置中爱迪生蓄电池的负极是________ (填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是__________ 。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式__________________________ 。
③你认为高铁酸钠作为一种新型净水剂的理由可能是______ 。
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:
铁锈的主要成分是
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O
 Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
①此装置中爱迪生蓄电池的负极是
②写出在用电解法制取高铁酸钠时,阳极的电极反应式
③你认为高铁酸钠作为一种新型净水剂的理由可能是
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质
您最近一年使用:0次
【推荐1】甲醇 又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。
又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。
(1)工业上可利用 和
和 生产甲醇,方程式如下:
生产甲醇,方程式如下:


又查资料得知:①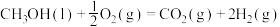
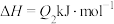
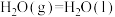
 ,则表示甲醇标准燃烧热的热化学方程式为
,则表示甲醇标准燃烧热的热化学方程式为__________________ 。
(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,如图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为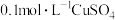 溶液(假设反应前后溶液体积不变),当向甲池通入物质
溶液(假设反应前后溶液体积不变),当向甲池通入物质 和
和 时,
时, 极附近呈红色。
极附近呈红色。

①物质 的化学式为
的化学式为______ , 电极的电极反应式为
电极的电极反应式为____________ 。
②乙装置中D电极方程式为__________________ 。
③丙装置中总反应的离子方程式为__________________ 。
④当乙装置中 电极收集到
电极收集到 (标况下)气体时,丙中溶液的
(标况下)气体时,丙中溶液的
______  。
。
 又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。
又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。(1)工业上可利用
 和
和 生产甲醇,方程式如下:
生产甲醇,方程式如下:

又查资料得知:①
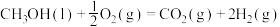
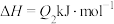
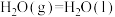
 ,则表示甲醇标准燃烧热的热化学方程式为
,则表示甲醇标准燃烧热的热化学方程式为(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,如图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为
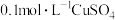 溶液(假设反应前后溶液体积不变),当向甲池通入物质
溶液(假设反应前后溶液体积不变),当向甲池通入物质 和
和 时,
时, 极附近呈红色。
极附近呈红色。
①物质
 的化学式为
的化学式为 电极的电极反应式为
电极的电极反应式为②乙装置中D电极方程式为
③丙装置中总反应的离子方程式为
④当乙装置中
 电极收集到
电极收集到 (标况下)气体时,丙中溶液的
(标况下)气体时,丙中溶液的
 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】依据如图所示三套实验装置,分别回答下列问题。
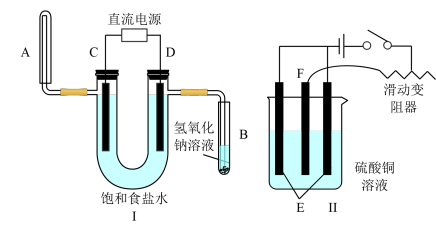
(1)装置Ⅰ的实验目的是用惰性电极电解饱和食盐水,C电极连接电源的___________ 极,B管吸收的气体是___________ ,电解食盐水总反应的离子方程式为___________ 。
(2)装置Ⅱ的实验目的是在铁棒上镀铜,铁棒为___________ (填“E”或“F”)。
(3)如下装置利用 与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图,
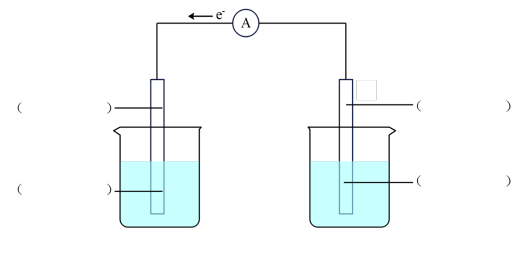
与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图,_______ 、_________ 、___________ 、_____________

(1)装置Ⅰ的实验目的是用惰性电极电解饱和食盐水,C电极连接电源的
(2)装置Ⅱ的实验目的是在铁棒上镀铜,铁棒为
(3)如下装置利用
 与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图,
与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图,供选择的实验用品:KCl溶液, 溶液, 溶液, 溶液, 溶液, 溶液,铜棒,锌棒,铁棒,石墨棒,氯化钾盐桥。 溶液,铜棒,锌棒,铁棒,石墨棒,氯化钾盐桥。 |

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。

I.如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,各加入生铁块,放置一段时间均被腐蚀,这两种腐蚀都属于_________ 腐蚀。(填“化学腐蚀”或“电化学腐蚀”)
(1)红墨水柱两边的液面变为左低右高,则______ (填“a”或“b”)边盛有食盐水。
(2)b试管中铁发生的是______ 腐蚀,(填“析氢腐蚀”或“吸氧腐蚀”)生铁中碳上发生的电极反应式___________ 。
Ⅱ.下图装置的盐桥中盛有饱和NH4NO3琼脂溶液,能够连接两份电解质溶液,形成闭合回路:

(1)该装置的能量转化形式为:__________ ,装置工作时,盐桥中的NH4+移向__________ 。(“CuSO4溶液”或“AgNO3溶液”)
(2)若将盐桥换成铜丝,电路中也有电流通过,则铜丝左端为_________ 极,该极反应式为:__________________________________ 。

I.如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,各加入生铁块,放置一段时间均被腐蚀,这两种腐蚀都属于
(1)红墨水柱两边的液面变为左低右高,则
(2)b试管中铁发生的是
Ⅱ.下图装置的盐桥中盛有饱和NH4NO3琼脂溶液,能够连接两份电解质溶液,形成闭合回路:

(1)该装置的能量转化形式为:
(2)若将盐桥换成铜丝,电路中也有电流通过,则铜丝左端为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】某化学学习小组学习电化学后。设计了下面的实验装置图(合上电键):

(1)电极名称,铜电极___ (填写“正极”、“负极”、“阴极”、“阳极”,下同),银电极_____ 。
(2)丙池石墨电板上发生的电极反应式为_______ ,丁池中发生反应的离子方程式为_______ 。
(3)一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生______ g固体。

(1)电极名称,铜电极
(2)丙池石墨电板上发生的电极反应式为
(3)一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池。

①当电解质溶液为稀硫酸时:Cu电极是___________ (填“正”或“负”)极,其电极反应为___________ ;
②当电解质溶液为浓硝酸时:Cu电极是___________ 极,其电极反应为___________ 。
(2)请写出电解硫酸铜溶液的总化学方程式___________ 。
(3)燃烧氢气时耗氧量小,放出热量多。已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为:___________ 。
(4)下图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极发生的电极反应式:___________ 。

(5)请根据下面所给出的5个热化学方程式,判断反应④的反应热ΔH4是___________ 。
①NH3(g)+HCl(g)=NH4Cl(s) ΔH1=-176 kJ·mol-1
②NH3(g)+H2O(l)=NH3·H2O(aq) ΔH2=-35.1 kJ·mol-1
③HCl(g)+H2O(l)=HCl(aq) ΔH3=-72.3 kJ·mol-1
④NH4Cl(s)+H2O(l)=NH4Cl(aq) ΔH4=?
⑤NH3·H2O(aq)+HCl(aq)=NH4Cl(aq)+H2O(l) ΔH5=-52.3 kJ·mol-1
(1)如图所示,组成一个原电池。

①当电解质溶液为稀硫酸时:Cu电极是
②当电解质溶液为浓硝酸时:Cu电极是
(2)请写出电解硫酸铜溶液的总化学方程式
(3)燃烧氢气时耗氧量小,放出热量多。已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为:
(4)下图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极发生的电极反应式:

(5)请根据下面所给出的5个热化学方程式,判断反应④的反应热ΔH4是
①NH3(g)+HCl(g)=NH4Cl(s) ΔH1=-176 kJ·mol-1
②NH3(g)+H2O(l)=NH3·H2O(aq) ΔH2=-35.1 kJ·mol-1
③HCl(g)+H2O(l)=HCl(aq) ΔH3=-72.3 kJ·mol-1
④NH4Cl(s)+H2O(l)=NH4Cl(aq) ΔH4=?
⑤NH3·H2O(aq)+HCl(aq)=NH4Cl(aq)+H2O(l) ΔH5=-52.3 kJ·mol-1
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】铬及其化合物在催化、金属防腐等方面具有重要应用。回答下列问题:
(1)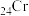 属于
属于___________ 区元素。
(2) 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___________ (列式表示)。

(3) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(i)

(ii)
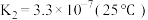
①下列有关 溶液的说法正确的有
溶液的说法正确的有___________ (填字母)。
a.加入少量硫酸溶液,溶液的pH不变
B.加入少量水稀释,溶液中所有离子的浓度均减小
C.加入少量硫酸溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时
固体,平衡时 与
与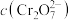 的比值保持不变
的比值保持不变
②25℃时, 溶液中,设
溶液中,设 、
、 与
与 的平衡浓度分别为x、y、
的平衡浓度分别为x、y、 ,则x、y、z之间的关系式为
,则x、y、z之间的关系式为___________ 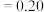
③电解铬酸钾溶液制备重铬酸钾的装置示意图如图所示,请写出该制备过程总反应的化学方程式为___________ 。

(1)
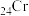 属于
属于(2)
 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为
(3)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(i)


(ii)

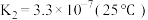
①下列有关
 溶液的说法正确的有
溶液的说法正确的有a.加入少量硫酸溶液,溶液的pH不变
B.加入少量水稀释,溶液中所有离子的浓度均减小
C.加入少量硫酸溶液,反应(ⅰ)的平衡逆向移动
D.加入少量
 固体,平衡时
固体,平衡时 与
与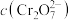 的比值保持不变
的比值保持不变②25℃时,
 溶液中,设
溶液中,设 、
、 与
与 的平衡浓度分别为x、y、
的平衡浓度分别为x、y、 ,则x、y、z之间的关系式为
,则x、y、z之间的关系式为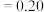
③电解铬酸钾溶液制备重铬酸钾的装置示意图如图所示,请写出该制备过程总反应的化学方程式为

您最近一年使用:0次



