葡萄糖酸锌[Zn(C6H11O7)2]是一种有机补锌剂,广泛应用于食药领域。已知葡萄糖酸锌能溶于水,易溶于热水,不溶于乙醇,稍高于100℃即开始分解。某小组由葡萄糖制备葡萄糖酸锌的实验步骤如下:
Ⅰ.制备葡萄糖酸(C6H12O7):60℃水浴下,向一定体积葡萄糖溶液中滴入1%溴水至略过量,保温5min。
Ⅱ.制备葡萄糖酸钙[Ca(C6H11O7)2]:将略过量高纯CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生。过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用。
Ⅲ.制备葡萄糖酸锌粗品:在90℃水浴、搅拌下,向ZnSO4溶液中分批加入葡萄糖酸钙溶液。趁热过滤,向滤液中加入无水乙醇并冷却析晶,过滤。
请回答下列问题:
(1)步骤Ⅰ中发生反应的化学方程式为___________ 。
(2)步骤Ⅲ中反应控温在90℃的原因为___________ 。
(3)步骤Ⅲ中向滤液中加入无水乙醇的作用是___________ 。
(4)高纯CaCO3的制备。请设计以石灰石(含少量铁的氧化物,其他杂质不考虑)、盐酸,碳酸铵溶液为原料制备高纯碳酸钙的实验方案:边搅拌边将石灰石粉末分批加入稀盐酸中,至不再有气泡产生,___________ ,得到高纯CaCO3。(实验中须使用的试剂有:氨水、H2O2溶液、HNO3溶液、AgNO3溶液)
Ⅰ.制备葡萄糖酸(C6H12O7):60℃水浴下,向一定体积葡萄糖溶液中滴入1%溴水至略过量,保温5min。
Ⅱ.制备葡萄糖酸钙[Ca(C6H11O7)2]:将略过量高纯CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生。过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用。
Ⅲ.制备葡萄糖酸锌粗品:在90℃水浴、搅拌下,向ZnSO4溶液中分批加入葡萄糖酸钙溶液。趁热过滤,向滤液中加入无水乙醇并冷却析晶,过滤。
请回答下列问题:
(1)步骤Ⅰ中发生反应的化学方程式为
(2)步骤Ⅲ中反应控温在90℃的原因为
(3)步骤Ⅲ中向滤液中加入无水乙醇的作用是
(4)高纯CaCO3的制备。请设计以石灰石(含少量铁的氧化物,其他杂质不考虑)、盐酸,碳酸铵溶液为原料制备高纯碳酸钙的实验方案:边搅拌边将石灰石粉末分批加入稀盐酸中,至不再有气泡产生,
更新时间:2021-09-10 16:04:53
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】溴苯是一种常见的化工原料。查阅资料知:苯和液溴在溴化铁(FeBr3)存在的条件下可发生反应生成溴苯,此反应为放热反应。实验室合成溴苯的装置示意图及有关数据如下。先向A中加入16.0mL的无水苯和5.0mL液溴,再将混合液慢慢滴入反应器B中。请回答下列问题:
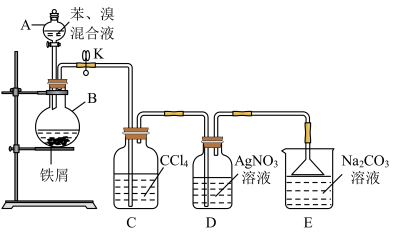
(1)仪器A的名称为____ 。
(2)反应器B中发生的主要有机反应的化学方程式是___ 。
(3)下列关于该实验操作或叙述错误的是___ (填字母序号)。
a.向反应器B中滴加苯和溴的混合液前需先关闭K
b.实验中装置C中的液体逐渐变为浅红色
c.实验中装置D中的导管口附近有白雾产生,溶液中产生淡黄色的沉淀,根据该现象说明苯和液溴发生的反应为加成反应
d.装置D中的导管不能插入液面以下和装置E中导管末端连接倒扣着的漏斗都是为了防倒吸
e.溴苯不能与AgNO3溶液反应产生淡黄色沉淀
(4)实验完毕待冷却后,经过下列步骤对溴苯进行分离提纯:
①向B中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。用NaOH溶液洗涤的作用是___ ;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为__ ,要进一步提纯,下列操作中必须的是___ 。
a.萃取 b.蒸馏 c.重结晶 d.过滤 e.分液
(6)若经过上述分离提纯的操作,经进一步精制得到6.2mL的溴苯,则该实验中溴苯的产率是___ (计算结果保留三位有效数字)。
| 苯 | 溴 | 溴苯 | |
| 相对分子质量 | 78 | 160 | 157 |
| 颜色状态 | 无色液体 | 深红棕色液体 | 无色液体 |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中的溶解性 | 难溶 | 微溶 | 难溶 |

(1)仪器A的名称为
(2)反应器B中发生的主要有机反应的化学方程式是
(3)下列关于该实验操作或叙述错误的是
a.向反应器B中滴加苯和溴的混合液前需先关闭K
b.实验中装置C中的液体逐渐变为浅红色
c.实验中装置D中的导管口附近有白雾产生,溶液中产生淡黄色的沉淀,根据该现象说明苯和液溴发生的反应为加成反应
d.装置D中的导管不能插入液面以下和装置E中导管末端连接倒扣着的漏斗都是为了防倒吸
e.溴苯不能与AgNO3溶液反应产生淡黄色沉淀
(4)实验完毕待冷却后,经过下列步骤对溴苯进行分离提纯:
①向B中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。用NaOH溶液洗涤的作用是
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为
a.萃取 b.蒸馏 c.重结晶 d.过滤 e.分液
(6)若经过上述分离提纯的操作,经进一步精制得到6.2mL的溴苯,则该实验中溴苯的产率是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】草酸是一种常用的除锈剂、还原剂和滴定剂。某小组以电石(主要成分是 ,含少量CaS、
,含少量CaS、 杂质)为原料制备草酸并探究草酸性质、测定粗草酸产品纯度。
杂质)为原料制备草酸并探究草酸性质、测定粗草酸产品纯度。

已知:
① 在常温下与
在常温下与 发生复分解反应。
发生复分解反应。
② 溶液吸收
溶液吸收 的产物与反应物相对量有关。
的产物与反应物相对量有关。
请回答下列问题:
(1)C的作用是_______ 。
(2)A中用饱和食盐水和电石反应,化学方程式为_______ 。
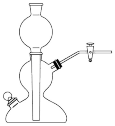
(3)A_______ (填“能”或“不能”)用如图仪器替代,理由是_______ 。
(4)实验完毕后,采用结晶法从D中分离出草酸晶体( ),配成草酸溶液进行如下实验:
),配成草酸溶液进行如下实验:
①实验ⅰ中离子方程式为_______ 。
②实验ⅲ中氧化产物是_______ 。
(5)称取w g草酸( )粗产品配制250mL溶液,准确量取25.00mL所配制溶液于锥形瓶,加入少量稀硫酸,用标准c
)粗产品配制250mL溶液,准确量取25.00mL所配制溶液于锥形瓶,加入少量稀硫酸,用标准c 
 溶液滴定至终点,消耗滴定液V mL。该粗产品纯度为
溶液滴定至终点,消耗滴定液V mL。该粗产品纯度为_______ %。如果实验前用 溶液润洗锥形瓶,则测得结果
溶液润洗锥形瓶,则测得结果_______ (填“偏高”“偏低”或“无影响”)。
 ,含少量CaS、
,含少量CaS、 杂质)为原料制备草酸并探究草酸性质、测定粗草酸产品纯度。
杂质)为原料制备草酸并探究草酸性质、测定粗草酸产品纯度。
已知:
①
 在常温下与
在常温下与 发生复分解反应。
发生复分解反应。②
 溶液吸收
溶液吸收 的产物与反应物相对量有关。
的产物与反应物相对量有关。请回答下列问题:
(1)C的作用是
(2)A中用饱和食盐水和电石反应,化学方程式为
(3)A

(4)实验完毕后,采用结晶法从D中分离出草酸晶体(
 ),配成草酸溶液进行如下实验:
),配成草酸溶液进行如下实验:| 实验 | 装置 | 试剂R | 现象 |
| ⅰ | 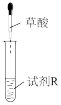 | 澄清石灰水 | 产生白色沉淀 |
| ⅱ | 饱和 溶液 溶液 | 产生气泡 | |
| ⅲ | 酸性 溶液 溶液 | 溶液由橙色变为绿色( ) ) | |
| ⅳ | 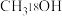 和浓硫酸 和浓硫酸 | 加热后产生有香味油状物质 |
②实验ⅲ中氧化产物是
(5)称取w g草酸(
 )粗产品配制250mL溶液,准确量取25.00mL所配制溶液于锥形瓶,加入少量稀硫酸,用标准c
)粗产品配制250mL溶液,准确量取25.00mL所配制溶液于锥形瓶,加入少量稀硫酸,用标准c 
 溶液滴定至终点,消耗滴定液V mL。该粗产品纯度为
溶液滴定至终点,消耗滴定液V mL。该粗产品纯度为 溶液润洗锥形瓶,则测得结果
溶液润洗锥形瓶,则测得结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】丙二酸单乙酯是重要的中间体,被广泛应用于天然产物及医药的化学合成中。以下是一种以丙二酸二乙酯为原料来制备丙二酸单乙酯的实验方法,反应原理如下:

实验步骤:
步骤1:将25.0g(0.156mol)丙二酸二乙酯和100 mL无水乙醇加入三颈烧瓶中,用恒压滴液漏斗.缓慢滴加含8.75g(0.156mol) KOH的100 mL无水乙醇溶液,继续冷凝回流反应1 h (实验装置如图甲),待烧瓶中出现大量固体,冷却、抽滤( 即减压过滤,装置如图乙)、洗涤,即得到丙二酸单乙酯钾盐;将滤液减压蒸馏,浓缩至60mL左右,冷却、抽滤、洗涤,再得到丙二酸单乙酯钾盐。
步骤2:将所得钾盐合并后置于烧杯中,加入15 mL.水,冰水冷却下充分搅拌使固体溶解,缓慢滴加13mL浓盐酸,搅拌、充分反应后分液,水层用乙酸乙酯萃取,合并有机层,用饱和食盐水萃取,加入无水Na2SO4,减压蒸馏除尽乙酸乙酯,得到18.25g丙二酸单乙酯(相对分子质量为132)。
已知:温度过高丙二酸单乙酯会发生脱羧反应。


回答下列问题:
(1)仪器X的名称为________ ,其进水口是_____ (填“上口”或“下口”);三颈烧瓶的规格应选用___ (填标号)。
a.100mL b.250mL. c.500mL d.1000mL
(2)步骤1中,需用无水乙醇作溶剂,其作用是________ ,丙二酸二乙酯与KOH反应时,若KOH稍过量或其醇溶液的滴加速度较快,均会导致的结果是_________ ;减压过滤的优点主要是______________ 。
(3)步骤2中,水层用乙酸乙酯萃取是为了获取其中少量溶解的_____ 。(填名称);无水Na2SO4的作用是______________ ;分离乙酸乙酯和丙二酸单乙酯的混合物时,采用减压蒸馏的原因是____________ 。
(4)本次实验的产率是_______ (列出计算式并计算)。

实验步骤:
步骤1:将25.0g(0.156mol)丙二酸二乙酯和100 mL无水乙醇加入三颈烧瓶中,用恒压滴液漏斗.缓慢滴加含8.75g(0.156mol) KOH的100 mL无水乙醇溶液,继续冷凝回流反应1 h (实验装置如图甲),待烧瓶中出现大量固体,冷却、抽滤( 即减压过滤,装置如图乙)、洗涤,即得到丙二酸单乙酯钾盐;将滤液减压蒸馏,浓缩至60mL左右,冷却、抽滤、洗涤,再得到丙二酸单乙酯钾盐。
步骤2:将所得钾盐合并后置于烧杯中,加入15 mL.水,冰水冷却下充分搅拌使固体溶解,缓慢滴加13mL浓盐酸,搅拌、充分反应后分液,水层用乙酸乙酯萃取,合并有机层,用饱和食盐水萃取,加入无水Na2SO4,减压蒸馏除尽乙酸乙酯,得到18.25g丙二酸单乙酯(相对分子质量为132)。
已知:温度过高丙二酸单乙酯会发生脱羧反应。


回答下列问题:
(1)仪器X的名称为
a.100mL b.250mL. c.500mL d.1000mL
(2)步骤1中,需用无水乙醇作溶剂,其作用是
(3)步骤2中,水层用乙酸乙酯萃取是为了获取其中少量溶解的
(4)本次实验的产率是
您最近一年使用:0次



