某学习小组按如下实验流程探究海带中碘含量的测定和单质碘的制取与应用。
实验(一) 碘含量的测定
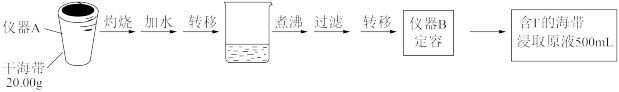
取0.0100 的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中
的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中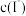 的变化,部分数据如下表:
的变化,部分数据如下表:
请回答:
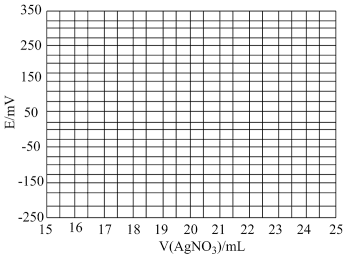
(1)①根据表中数据绘制滴定曲线:___________
②该次滴定终点时用去AgNO3溶液的体积为___________ mL,计算得海带中碘的百分含量为___________ %。
实验(二) 维生素C含量的测定
(2)将精制得到的I2配成浓度为 的标准溶液,用来测定某样品中维生素C(相对分子质量为M)的含量。具体操作如下:准确称量ag样品,溶于新煮沸过并冷却至室温的蒸馏水中,煮沸蒸馏水的目的是
的标准溶液,用来测定某样品中维生素C(相对分子质量为M)的含量。具体操作如下:准确称量ag样品,溶于新煮沸过并冷却至室温的蒸馏水中,煮沸蒸馏水的目的是___________ 。用250mL容量瓶定容,使用___________ (填仪器)量取25.00mL样品溶液于锥形瓶中,再加入10mL1:1醋酸溶液和适量的___________ 指示剂,立即用I2标准溶液滴定,溶液显稳定的___________ (填颜色)即为滴定终点,消耗I2标准溶液VmL,则样品中维生素C的质量分数是____ (写出表达式)。已知滴定反应方程式:  +I2
+I2
 +2HI
+2HI
实验(一) 碘含量的测定
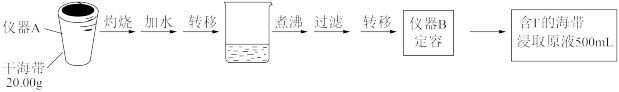
取0.0100
 的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中
的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中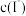 的变化,部分数据如下表:
的变化,部分数据如下表:| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | 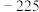 | 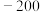 | 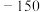 | 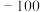 | 50.0 | 175 | 275 | 300 | 325 |

(1)①根据表中数据绘制滴定曲线:
②该次滴定终点时用去AgNO3溶液的体积为
实验(二) 维生素C含量的测定
(2)将精制得到的I2配成浓度为
 的标准溶液,用来测定某样品中维生素C(相对分子质量为M)的含量。具体操作如下:准确称量ag样品,溶于新煮沸过并冷却至室温的蒸馏水中,煮沸蒸馏水的目的是
的标准溶液,用来测定某样品中维生素C(相对分子质量为M)的含量。具体操作如下:准确称量ag样品,溶于新煮沸过并冷却至室温的蒸馏水中,煮沸蒸馏水的目的是 +I2
+I2
 +2HI
+2HI
更新时间:2021-11-09 21:58:35
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】按要求填空:
(1)写出碳酸第一步电离的离子方程式:_____________________________
(2)写出氯化铵溶液水解的离子方程式:____________________________
(3)实验室中有一未知浓度的稀盐酸,某同学在实验室测定盐酸的浓度。请完成下列填空:
首先,配制100mL 0.10mol/L NaOH标准溶液。
① 配制过程中,请计算需要称量_____ g氢氧化钠固体。然后,取20.00mL待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
② 下列滴定操作的顺序正确的是 ( )
a.检查滴定管是否漏水
b.用蒸馏水洗涤玻璃仪器
c.用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
d.装标准溶液和待测液并排出气泡调整液面(记录初始读数)
e.取一定体积的待测液于锥形瓶中并滴加适量指示剂
f.滴定
A. acbdef B. abcdef C. bcadef D. deabcf
③ 滴定达到终点的标志是________________________ 。
④ 根据上述数据,可计算出该盐酸的浓度为________ 。
⑤ 造成测定结果偏高的原因可能是( )
A. 振荡锥形瓶时,部分未知液溅出液体
B. 滴定终点读数时,俯视滴定管的刻度,其他操作正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(1)写出碳酸第一步电离的离子方程式:
(2)写出氯化铵溶液水解的离子方程式:
(3)实验室中有一未知浓度的稀盐酸,某同学在实验室测定盐酸的浓度。请完成下列填空:
首先,配制100mL 0.10mol/L NaOH标准溶液。
① 配制过程中,请计算需要称量
| 编号 | NaOH溶液的浓度mol/L | 滴定消耗NaOH溶液的体积mL | 待测盐酸的体积mL |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 21.98 | 20.00 |
| 3 | 0.10 | 23.98 | 20.00 |
a.检查滴定管是否漏水
b.用蒸馏水洗涤玻璃仪器
c.用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
d.装标准溶液和待测液并排出气泡调整液面(记录初始读数)
e.取一定体积的待测液于锥形瓶中并滴加适量指示剂
f.滴定
A. acbdef B. abcdef C. bcadef D. deabcf
③ 滴定达到终点的标志是
④ 根据上述数据,可计算出该盐酸的浓度为
⑤ 造成测定结果偏高的原因可能是
A. 振荡锥形瓶时,部分未知液溅出液体
B. 滴定终点读数时,俯视滴定管的刻度,其他操作正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】兴趣小组同学用0.1mol•L-1的标准KOH溶液滴定未知浓度的盐酸,操作如下:
①移取25.00mL待测盐酸注入洁净的锥形瓶中,并加入2~3滴酚酞;
②用标准KOH溶液润洗滴定管2~3次;
③取标准KOH溶液注入滴定管至0刻度线以上2~3cm;
④将盛有标准KOH溶液的滴定管固定好,调节液面使滴定管尖嘴充满溶液;
⑤调节液面至0刻度或0刻度以下,记下读数;
⑥将锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。
(1)正确的操作顺序是______ (填序号)。
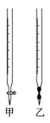
(2)操作②中使用的滴定管为图中的______ (填“甲”或“乙”)。
(3)若用25mL滴定管进行实验,当滴定管中的液面在“10”处时,管内液体的体积______ (填字母)。
(4)步骤⑥达到滴定终点的标志是_______ 。
(5)实验数据记录如表:
计算待测盐酸的物质的量浓度为______ mol/L。
(6)下列操作对所测盐酸的浓度有何影响?(填“偏大”、“偏小”或“无影响”)
A.进行步骤①之前,先用待测液润洗锥形瓶______ ;
B.所用KOH固体中含有少量NaOH杂质______ ;
C.滴定前装有待测溶液的滴定管尖嘴部分有气泡,滴定结束后气泡消失______ 。
①移取25.00mL待测盐酸注入洁净的锥形瓶中,并加入2~3滴酚酞;
②用标准KOH溶液润洗滴定管2~3次;
③取标准KOH溶液注入滴定管至0刻度线以上2~3cm;
④将盛有标准KOH溶液的滴定管固定好,调节液面使滴定管尖嘴充满溶液;
⑤调节液面至0刻度或0刻度以下,记下读数;
⑥将锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。
(1)正确的操作顺序是
(2)操作②中使用的滴定管为图中的

(3)若用25mL滴定管进行实验,当滴定管中的液面在“10”处时,管内液体的体积
| A.等于10mL | B.等于15mL | C.小于10mL | D.大于15mL |
(5)实验数据记录如表:
| 实验编号 | 待测盐酸体积(mL) | 消耗标准KOH溶液的体积(mL) | |
| 滴定开始读数 | 滴定结束读数 | ||
| i | 25.00 | 0.00 | 19.95 |
| ii | 25.00 | 1.10 | 18.30 |
| iii | 25.00 | 0.20 | 20.25 |
(6)下列操作对所测盐酸的浓度有何影响?(填“偏大”、“偏小”或“无影响”)
A.进行步骤①之前,先用待测液润洗锥形瓶
B.所用KOH固体中含有少量NaOH杂质
C.滴定前装有待测溶液的滴定管尖嘴部分有气泡,滴定结束后气泡消失
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】利用如图所示装置测定中和热的实验步骤如下:
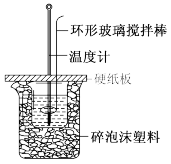
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,用温度计测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温 度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)该同学每次分别取50 mL 0.50 mol·L-1 NaOH溶液和30 mL 0.50 mol·L -1硫酸进行实验,通过多次实验测定中和热ΔH= -53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是___________ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(3)现将一定量的氢氧化钠稀溶液、氢氧化钙稀溶液、稀氨水分别和1 L 1 mol·L-1稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___________ 。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·c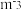 ,又知中和反应后溶液的比热容c=4.18 J·
,又知中和反应后溶液的比热容c=4.18 J· ·
·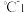 。为了计算中和热,某学生记录数据如下:
。为了计算中和热,某学生记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=___________ (结果保留一位小数)。
(5)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸的原因是___________ 。

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,用温度计测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温 度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)该同学每次分别取50 mL 0.50 mol·L-1 NaOH溶液和30 mL 0.50 mol·L -1硫酸进行实验,通过多次实验测定中和热ΔH= -53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(3)现将一定量的氢氧化钠稀溶液、氢氧化钙稀溶液、稀氨水分别和1 L 1 mol·L-1稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·c
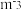 ,又知中和反应后溶液的比热容c=4.18 J·
,又知中和反应后溶液的比热容c=4.18 J· ·
·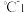 。为了计算中和热,某学生记录数据如下:
。为了计算中和热,某学生记录数据如下:| 实验序号 | 起始温度T1/ ℃ | 终止温度T2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(5)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】如图是海带中提取碘的流程图:
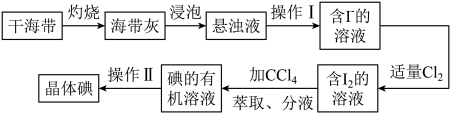
回答下列问题。
(1)干海带在________ 中灼烧(填仪器名称)。
(2)操作I名称为_________ 。
(3)分液漏斗在使用前须清洗干净并________ ,在本实验分离过程中,碘的四氯化碳应该从分液漏斗的________ (填“上口倒出”或“下口放出”)。
(4)操作II名称为________ ,该操作中加入碎瓷片的作用是________ ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________ (填标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(5)在操作II中,仪器选择及安装都最合理的是_______ (填标号)。
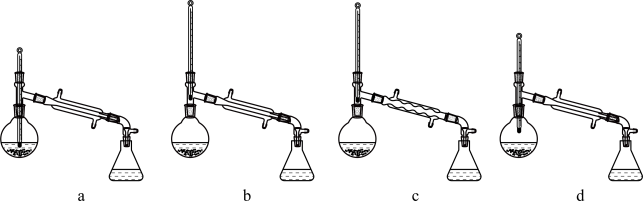
(6)通入适当Cl2时,氧化剂和还原剂的物质的量比_______ 。

回答下列问题。
(1)干海带在
(2)操作I名称为
(3)分液漏斗在使用前须清洗干净并
(4)操作II名称为
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(5)在操作II中,仪器选择及安装都最合理的是

(6)通入适当Cl2时,氧化剂和还原剂的物质的量比
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】碘是人体必需的元素之一,海带中含有丰富的碘元素。灼烧海带获取的海带灰中,碘元素主要以I-形式存在。在实验室中,从海带灰中提取碘的流程如下:
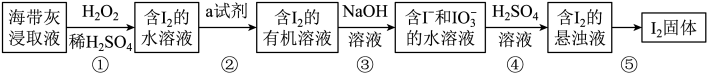
回答下列问题:
(1)实验室灼烧海带的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、_______ 等
(2)下列关于卤族元素单质储存的说法错误的是_______;(填字母)
(3)写出步骤①中发生反应的离子方程式:_______ ;
(4)步骤②中提取碘的过程中,可选择的有机试剂是_______;(填字母)
(5)下列有关萃取、分液的说法错误的是
(6)写出步骤③中发生反应的离子方程式:_______ ;在此反应中,每消耗3.81gI2转移_______ mol电子;
(7)上述流程中,含I2的水溶液经3步转化为含I2的悬浊液,主要目的是_______ 。

回答下列问题:
(1)实验室灼烧海带的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、
(2)下列关于卤族元素单质储存的说法错误的是_______;(填字母)
| A.将氟气压缩成液氟储存在钢瓶中 |
| B.将氯气压缩成液氯储存在钢瓶中 |
| C.溴单质保存在棕色瓶中,不需要加水封存 |
| D.碘单质保存在棕色广口瓶中 |
(4)步骤②中提取碘的过程中,可选择的有机试剂是_______;(填字母)
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |
| A.萃取剂可以循环利用 |
| B.萃取振荡时,分液漏斗下口应倾斜向上 |
| C.分液时,应先从分液漏斗的下口放出下层液体,然后再从下口放出上层液体 |
| D.从下口放出下层液体前要先取下分液漏斗的塞子 |
(7)上述流程中,含I2的水溶液经3步转化为含I2的悬浊液,主要目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】海洋植物如海带、海藻中含有大量的碘元素,硬元素以碘离子的形式存在。实验室,里从海藻中提取碘的流程如图:
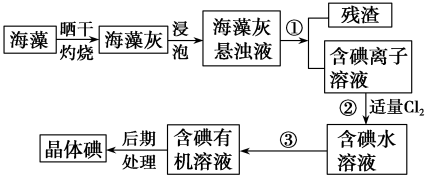
(1)实验室焙烧海带,需要下列仪器中的_______ (填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①_______ ,③_______ 。
(3)提取碘的过程中,可选择的有机试剂是_______。
(4)为使海藻灰中破离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有_______ 、_______ 。
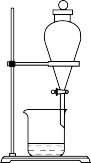
(5)某学习小组用 萃取碘水中的碘,在如图的分液漏斗中,下层液体呈
萃取碘水中的碘,在如图的分液漏斗中,下层液体呈_______ 色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_______ 。
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏。进行上述蒸馏操作时,使用了水浴加热。使用水浴加热的原因是_______ 。

(1)实验室焙烧海带,需要下列仪器中的
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①
(3)提取碘的过程中,可选择的有机试剂是_______。
| A.甲苯、酒精 | B.四氧化碳、苯 | C.汽油、乙酸 | D.汽油、甘油 |
(5)某学习小组用
 萃取碘水中的碘,在如图的分液漏斗中,下层液体呈
萃取碘水中的碘,在如图的分液漏斗中,下层液体呈
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏。进行上述蒸馏操作时,使用了水浴加热。使用水浴加热的原因是
您最近一年使用:0次



