某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
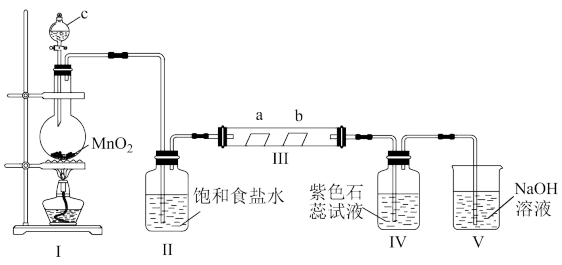
(1)装置Ⅰ中仪器c的名称是___________ ,实验室用二氧化锰和浓盐酸制备氯气的化学方程式为___________ 。
(2)装置Ⅴ中发生反应的离子方程式是___________ 。
(3)若产生Cl2足量,实验过程中装置Ⅳ中的实验现象是___________ 。
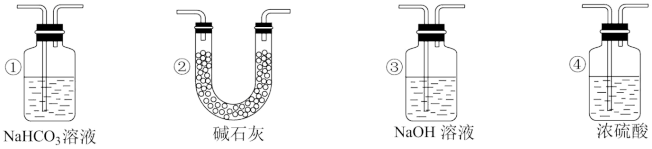
(4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的___________ 装置(填序号)。
(5)有一种“地康法”制取氯气的反应原理如图所示:
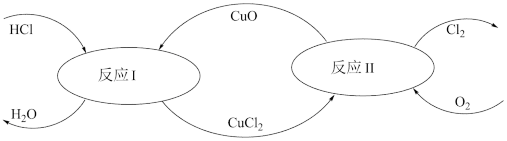
在450℃条件下,反应Ⅱ的化学方程式为___________ 。

(1)装置Ⅰ中仪器c的名称是
(2)装置Ⅴ中发生反应的离子方程式是
(3)若产生Cl2足量,实验过程中装置Ⅳ中的实验现象是
(4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的

(5)有一种“地康法”制取氯气的反应原理如图所示:

在450℃条件下,反应Ⅱ的化学方程式为
更新时间:2021-12-16 18:46:33
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】在抗击新冠肺炎疫情的战役中,84消毒液发挥着重要作用。实验小组对其进行研究。
【查阅资料】
①84消毒液的有效成分为次氯酸钠(NaClO),有效含氯量5.5%-6.5%;NaClO溶液呈碱性。
②消毒杀菌的原理是使菌体蛋白质变性,变性程度越大,消毒液消毒杀菌效果越好。鸡蛋清中的蛋白质发生变性反应时变为白色固体物质。
②ORP指84消毒液的漂白能力,ORP数值越大,84消毒液的漂白能力越强。
Ⅰ.制备84消毒液的有效成分NaClO
工业上能以食盐为原料制得次氯酸钠,其工业流程如图所示:
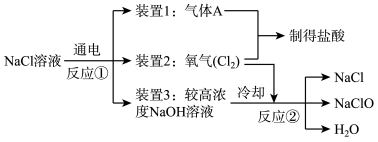
(1)装置1必须保证气密性良好并在其周围严禁明火,其原因是___ 。
(2)写出反应②的化学方程式___ 。
Ⅱ.探究84消毒液
实验1:在鸡蛋清中加入不同浓度的消毒液,静置15min现象如表:
实验2:探究84消毒液漂白性的影响因素:
【解释与结论】
(3)实验1的目的是___ 。
(4)实验2得出影响84消毒液失效的因素是___ 。
【反思与评价】
(5)生活中,84消毒液不能与洁厕灵(主要成分是盐酸)混合使用的原因是___ 。
Ⅲ.定量检测某品牌84消毒液中NaClO含量
依据原理:2HCl(浓)+NaClO═NaCl+Cl2↑+H2O
已知:①氯气的密度为3.17g/L;
②氯气可溶于水,且会与水反应,但基本不溶于饱和食盐水。
③氯化氢气体极易溶于水。
实验探究:测“84消毒液”样品中NaClO的质量分数。(不考虑消毒液中NaClO以外的物质与浓盐酸反应)
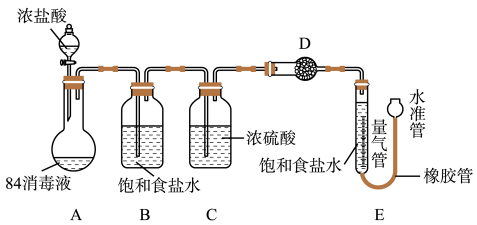
实验过程:
①连接装置并检查气密性;②准确称量10g“84消毒液”样品;③装药品,调节量气装置两边液面相平,读数;④加入浓盐酸,当不再有气体生成;⑤冷却到室温;⑥,读取量气管数值224mL。
(6)补全步骤⑥中的操作___ 。
(7)装置B的作用是___ ,D中的试剂是___ (填字母序号)。
a.碱石灰
b.浓硫酸
c.硫酸铜
(8)若其它操作均正确,仅因下列因素可使样品中NaClO的质量分数的测定结果偏小的是___ (填字母序号)。
a.反应前量气管水面到0刻度处,反应后仰视读数
b.装置A中仍有气泡就停止实验进行测量气体的体积
c.量气管中的食盐水不饱和
【查阅资料】
①84消毒液的有效成分为次氯酸钠(NaClO),有效含氯量5.5%-6.5%;NaClO溶液呈碱性。
②消毒杀菌的原理是使菌体蛋白质变性,变性程度越大,消毒液消毒杀菌效果越好。鸡蛋清中的蛋白质发生变性反应时变为白色固体物质。
②ORP指84消毒液的漂白能力,ORP数值越大,84消毒液的漂白能力越强。
Ⅰ.制备84消毒液的有效成分NaClO
工业上能以食盐为原料制得次氯酸钠,其工业流程如图所示:

(1)装置1必须保证气密性良好并在其周围严禁明火,其原因是
(2)写出反应②的化学方程式
Ⅱ.探究84消毒液
实验1:在鸡蛋清中加入不同浓度的消毒液,静置15min现象如表:
| 序号 | 1-1 | 1-2 | 1-3 | 1-4 |
| 实验操作 | 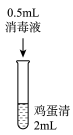 | 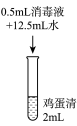 | 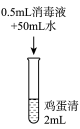 |  |
| 实验现象 | 实验液体表面产生大量气泡,无其他现象 | 液体中产生大量白色固体 | 液体中产生少量白色固体 | 液体中产生极少量白色固体 |
| 序号 | 2-1 | 2-2 |
| 实验操作 | 取烧杯倒入30mL浓度为1:100的84消毒液,将烧杯放置在距离光源10cm处进行光照,测量ORP变化 | 取四个烧杯,分别倒入30mL浓度为1:100的84消毒液,并置于20℃、30℃、40℃、50℃水溶中加热,测量ORP变化 |
| 测量数据 | 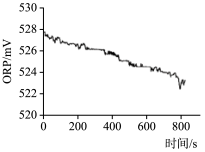 | 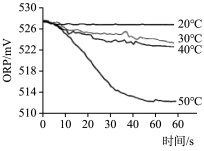 |
(3)实验1的目的是
(4)实验2得出影响84消毒液失效的因素是
【反思与评价】
(5)生活中,84消毒液不能与洁厕灵(主要成分是盐酸)混合使用的原因是
Ⅲ.定量检测某品牌84消毒液中NaClO含量
依据原理:2HCl(浓)+NaClO═NaCl+Cl2↑+H2O
已知:①氯气的密度为3.17g/L;
②氯气可溶于水,且会与水反应,但基本不溶于饱和食盐水。
③氯化氢气体极易溶于水。
实验探究:测“84消毒液”样品中NaClO的质量分数。(不考虑消毒液中NaClO以外的物质与浓盐酸反应)

实验过程:
①连接装置并检查气密性;②准确称量10g“84消毒液”样品;③装药品,调节量气装置两边液面相平,读数;④加入浓盐酸,当不再有气体生成;⑤冷却到室温;⑥,读取量气管数值224mL。
(6)补全步骤⑥中的操作
(7)装置B的作用是
a.碱石灰
b.浓硫酸
c.硫酸铜
(8)若其它操作均正确,仅因下列因素可使样品中NaClO的质量分数的测定结果偏小的是
a.反应前量气管水面到0刻度处,反应后仰视读数
b.装置A中仍有气泡就停止实验进行测量气体的体积
c.量气管中的食盐水不饱和
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】次氯酸溶液是常用的消毒剂.漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
【查阅资料】
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
【装置及实验】用以下装置制备次氯酸溶液
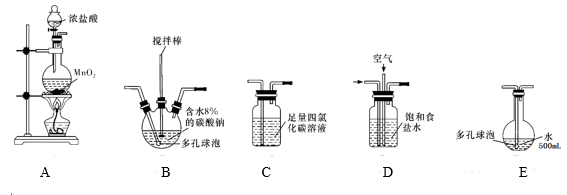
回答下列问题:
(1)各装置的连接顺序为_____ →_____ →_____ →____ →E。
(2)装置A中反应的离子方程式是______ 。
(3)装置E中反应的化学方程式是_____ 。
(4)装置 B 中多孔球泡和搅拌棒的作用是_______ ;反应过程中,装置B需放在冷水中,其目的是_____ 。
(5)装置C的主要作用是_____ 。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____ 。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___ g。
【查阅资料】
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
【装置及实验】用以下装置制备次氯酸溶液

回答下列问题:
(1)各装置的连接顺序为
(2)装置A中反应的离子方程式是
(3)装置E中反应的化学方程式是
(4)装置 B 中多孔球泡和搅拌棒的作用是
(5)装置C的主要作用是
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大。X是元素周期表中原子半径最小的元素,Y元素的最外层电子数是最内层电子数的2倍,Z元素的氢化物能与其最高价氧化物对应的水化物反应生成一种盐,W与X同主族,Q元素的单质是一种黄色晶体。请回答以下问题:
(1)Q元素在周期表中的位置_____ 。
(2)已知Z2X4结构中含非极性共价键,试画出其结构式(用元素符号表示):______ 。
(3)由Z与R组成的一种化合物M,摩尔质量不超过150g/mol,每个原子最外层均满足8e-稳定结构,其水溶液可用于漂白和杀菌,写出M与水初步反应的化学方程式______ 。
(4)根据KH中氢元素的化合价,甲同学认为可把氢元素放在第VIIA族,乙同学认为可把氢元素放在第IVA族,乙同学的理由是______ 。
(5)下列说法不正确 的是______ 。
(6)2.9g由X与Y组成的某化合物在足量的氧气中充分燃烧,然后将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重4.5g,碱石灰增重8.8g,则该化合物的结构简式为______ 。
(1)Q元素在周期表中的位置
(2)已知Z2X4结构中含非极性共价键,试画出其结构式(用元素符号表示):
(3)由Z与R组成的一种化合物M,摩尔质量不超过150g/mol,每个原子最外层均满足8e-稳定结构,其水溶液可用于漂白和杀菌,写出M与水初步反应的化学方程式
(4)根据KH中氢元素的化合价,甲同学认为可把氢元素放在第VIIA族,乙同学认为可把氢元素放在第IVA族,乙同学的理由是
(5)下列说法
| A.原子半径:W>Q>R |
| B.Q的氧化物的水化物一定是强酸 |
| C.在2mlR单质的饱和溶液中加入几滴紫色石蕊试剂,溶液显红色 |
| D.W与Q可形成既含离子键又含非极性共价键的化合物 |
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学兴趣小组设计了如图装置,该装置能制取 ,并进行相关性质实验,且可利用装置G储存多余的氯气。
,并进行相关性质实验,且可利用装置G储存多余的氯气。
注:溶解性 (1:500)、
(1:500)、 (1:700)。溶解性比较大的气体,通过玻璃导管直接通入
(1:700)。溶解性比较大的气体,通过玻璃导管直接通入 中,容易发生倒吸现象。
中,容易发生倒吸现象。
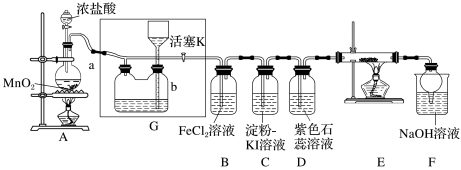
(1)A中发生反应的离子方程式为________________________________________ 。
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①在装置D中能看到的实验现象是___________________________________________ 。
②在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为 和
和 ,则E中发生反应的化学方程式为
,则E中发生反应的化学方程式为___________ 。
③装置F中球形干燥管的作用是______________________________ 。
(3)储气瓶b内盛放的试剂是_______________________________________________ 。
(4)装置B中 被
被 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为_____________________________________ 。
 ,并进行相关性质实验,且可利用装置G储存多余的氯气。
,并进行相关性质实验,且可利用装置G储存多余的氯气。注:溶解性
 (1:500)、
(1:500)、 (1:700)。溶解性比较大的气体,通过玻璃导管直接通入
(1:700)。溶解性比较大的气体,通过玻璃导管直接通入 中,容易发生倒吸现象。
中,容易发生倒吸现象。
(1)A中发生反应的离子方程式为
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①在装置D中能看到的实验现象是
②在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为
 和
和 ,则E中发生反应的化学方程式为
,则E中发生反应的化学方程式为③装置F中球形干燥管的作用是
(3)储气瓶b内盛放的试剂是
(4)装置B中
 被
被 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】实验室常用的几种气体发生装置如图A、B、C所示:
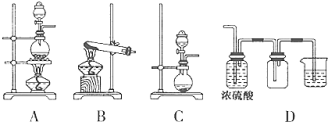
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是_____ 。检查C装置气密性是否良好的操作方法是________________ 。若用B装置制取氨气,用化学方程式表示制取氨气的反应原理_____________________ 。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的气体发生装置是_______ ,用离子方程式表示制取氯气的反应原理______________ 。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的______ 。
①CO2 ②NO ③Cl2 ④H2。
其中在D装置连接小烧杯目的是________________ ;发生反应的离子方程式为_____________________ 。
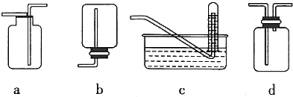
(4)下图是某同学设计收集氨气的几种装置,其中可行的是____________ 。

(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的气体发生装置是
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的
①CO2 ②NO ③Cl2 ④H2。
其中在D装置连接小烧杯目的是
(4)下图是某同学设计收集氨气的几种装置,其中可行的是

您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】NCl3可用于面粉的漂白和杀菌。已知:NCl3为黄色油状液体,在热水中易水解,熔点为-40°C,沸点为70°C,95°C以上易爆炸。实验室可用Cl2和NH4Cl溶液反应制取NCl3所用装置如下:

完成下列填空:
(1)仪器a的名称是_____ 。D装置盛装的物质是_____ ,D装置的作用是______ 。
(2)NCl3水解的反应液有漂白性,写出NCl3水解的化学方程式:_____ 。
(3)向NH4Cl溶液中通入过量Cl2,B装置中反应的化学方程式为_____ ,待反应至油状液体不再增加,关闭A、B装置间的止水夹,控制水浴加热的温度范围为_____ ,将产品NCl3蒸出。
待反应结束,为测定溶液中残留的NCl3的物质的量浓度,进行如下操作:
i.取仪器a中的反应液25.00mL,加入过量饱和Na2SO3溶液充分反应后,再加入过量30%的NaOH溶液,微热。
ii.用25.00mL0.050mol·L-1的稀硫酸吸收产生的NH3,得到溶液A。
iii.用0.100mol·L-1的NaOH标准溶液滴定溶液A至滴定终点,消耗VmLNaOH标准溶液。
(4)滴定至终点时溶液中溶质仅有(NH4)2SO4和Na2SO4,滴定过程中水的电离程度______ (填序号)。
a.先增大后减小 b.先减小后增大 c.增大 d.减小
(5)用含V的代数式表示溶液中残留的NCl3的物质的量浓度为_____ mol·L-1。

完成下列填空:
(1)仪器a的名称是
(2)NCl3水解的反应液有漂白性,写出NCl3水解的化学方程式:
(3)向NH4Cl溶液中通入过量Cl2,B装置中反应的化学方程式为
待反应结束,为测定溶液中残留的NCl3的物质的量浓度,进行如下操作:
i.取仪器a中的反应液25.00mL,加入过量饱和Na2SO3溶液充分反应后,再加入过量30%的NaOH溶液,微热。
ii.用25.00mL0.050mol·L-1的稀硫酸吸收产生的NH3,得到溶液A。
iii.用0.100mol·L-1的NaOH标准溶液滴定溶液A至滴定终点,消耗VmLNaOH标准溶液。
(4)滴定至终点时溶液中溶质仅有(NH4)2SO4和Na2SO4,滴定过程中水的电离程度_
a.先增大后减小 b.先减小后增大 c.增大 d.减小
(5)用含V的代数式表示溶液中残留的NCl3的物质的量浓度为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某小组同学利用一定浓度的HCl溶液和 制备
制备 ,并探究其相关的性质。
,并探究其相关的性质。
【探究一】制备氯气
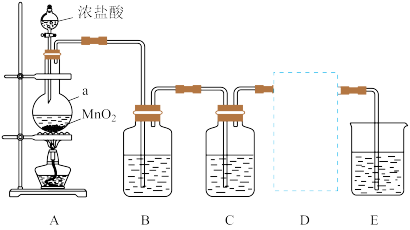
(1)写出装置A中发生反应的化学方程式______ 。
(2)A装置中仪器a的名称是______ ;装置B作用是______ 。
(3)装置D用于收集 ,气体应从集气瓶
,气体应从集气瓶______ (选“c”或“d”)口进入。

【探究二】利用氯气和相应的碱溶液反应制取NaClO和 ,并探究氯水的性质。
,并探究氯水的性质。
制备装置如图1所示(部分加持仪器略去),其中③中试管加有紫色石蕊试液。
【信息提示】氯气与碱反应,温度较高时生成 ,温度较低时生成
,温度较低时生成 。
。
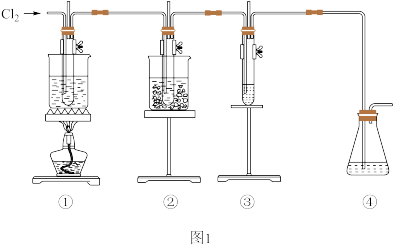
(4)①试管中的溶液是______ 。
(5)写出②中发生反应的化学方程式______ 。
(6)实验中可观察到③的试管中现象是______ 。
(7)验证氯水中HClO光照分解的产物。如图2所示将新制氯水置于三颈瓶内,pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中,用强光照射氯水,进行实验并采集数据,获得变化曲线如图3所示。
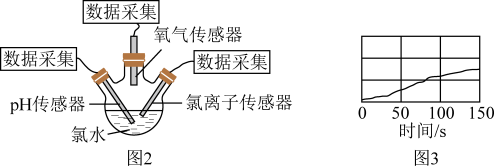
若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是______ (填字母)。(注:酸性溶液中, 越大,pH越小,溶液酸性越强。)
越大,pH越小,溶液酸性越强。)
a.氧气的体积分数;b.氢离子的浓度;c.氯离子的浓度;d.氯水的pH;e.溶液的颜色
 制备
制备 ,并探究其相关的性质。
,并探究其相关的性质。【探究一】制备氯气

(1)写出装置A中发生反应的化学方程式
(2)A装置中仪器a的名称是
(3)装置D用于收集
 ,气体应从集气瓶
,气体应从集气瓶
【探究二】利用氯气和相应的碱溶液反应制取NaClO和
 ,并探究氯水的性质。
,并探究氯水的性质。制备装置如图1所示(部分加持仪器略去),其中③中试管加有紫色石蕊试液。
【信息提示】氯气与碱反应,温度较高时生成
 ,温度较低时生成
,温度较低时生成 。
。
(4)①试管中的溶液是
(5)写出②中发生反应的化学方程式
(6)实验中可观察到③的试管中现象是
(7)验证氯水中HClO光照分解的产物。如图2所示将新制氯水置于三颈瓶内,pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中,用强光照射氯水,进行实验并采集数据,获得变化曲线如图3所示。

若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是
 越大,pH越小,溶液酸性越强。)
越大,pH越小,溶液酸性越强。)a.氧气的体积分数;b.氢离子的浓度;c.氯离子的浓度;d.氯水的pH;e.溶液的颜色
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
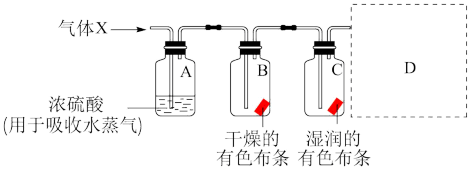
【推荐2】实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,某学习小组用如图装置研究Cl2的性质,请回答下列问题:
Ⅰ.制取氯气
(1)写出上述制氯气的化学方程式并标出电子转移的方向和数目___ 。
(2)在反应中MnO2发生___ (填“氧化”或“还原”)反应,Cl2是___ (同上)产物。
(3)当0.1 mol MnO2参加反应时,转移电子数为___ ,被氧化的HCl为___ mol。
Ⅱ.研究Cl2的性质
(4)分别描述B、C装置中的现象___ ;结合化学方程式及物质性质说明B、C装置中现象不同的原因___ 。
(5)Cl2是有毒气体,为了防止多余Cl2污染空气,可以在D处用如图装置进行尾气处理,用化学方程式表示该原理___ 。气体应该由___ (填“a”或“b”)管通入。若要吸收224 mLCl2(标况下),至少需要1 mol/L的上述溶液___ mL。

Ⅰ.制取氯气
(1)写出上述制氯气的化学方程式并标出电子转移的方向和数目
(2)在反应中MnO2发生
(3)当0.1 mol MnO2参加反应时,转移电子数为
Ⅱ.研究Cl2的性质
(4)分别描述B、C装置中的现象
(5)Cl2是有毒气体,为了防止多余Cl2污染空气,可以在D处用如图装置进行尾气处理,用化学方程式表示该原理

您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某同学利用下图装置制备并收集干燥纯净的Cl2,并探究Cl2与碱的反应。回答下列问题:
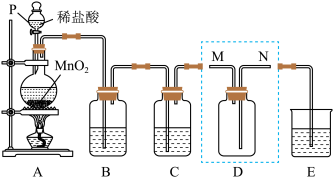
(1)仪器P的名称为___________ ,装置A中发生反应的化学方程式为___________ 。
(2)装置B的作用是___________ 。
(3)装置D用来收集纯净且干燥的氯气,进气口为___________ (填“M”或“N”)。
(4)探究 的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
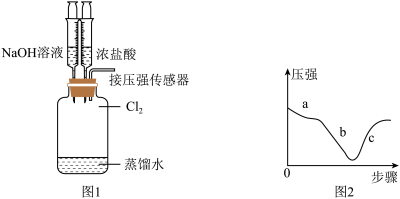
实验步骤如下:
a.向D中加入适量的蒸馏水,振荡。
b.用注射器向装置中加入NaOH溶液。
c.用注射器向装置中加入浓盐酸。
①步骤a,压强减小的原因___________ 。
②步骤b,Cl2与NaOH溶液反应的离子方程式___________ 。
③步骤c,装置D中的现象___________ 。

(1)仪器P的名称为
(2)装置B的作用是
(3)装置D用来收集纯净且干燥的氯气,进气口为
(4)探究
 的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
实验步骤如下:
a.向D中加入适量的蒸馏水,振荡。
b.用注射器向装置中加入NaOH溶液。
c.用注射器向装置中加入浓盐酸。
①步骤a,压强减小的原因
②步骤b,Cl2与NaOH溶液反应的离子方程式
③步骤c,装置D中的现象
您最近半年使用:0次



