如图所示三套实验装置,分别回答下列问题。
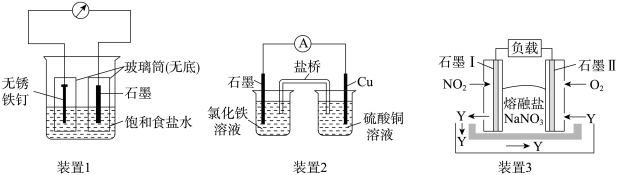
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,即可观察到铁钉附近的溶液出现蓝色沉淀,表明铁被___________ (填“氧化”或“还原”);向插入石墨的玻璃筒内滴入酚酞溶液,可观察到石墨附近的溶液变红,该电极反应式为___________ 。
(2)装置2中的石墨作___________ (填“正”或“负”)极,该装置发生的总反应的离子方程式为___________ 。
(3)装置3为由NO2、O2、熔融盐NaNO3组成的燃料电池示意图。在使用过程中石墨I电极反应生成一种氧化物Y,则Y为___________ (填化学式);石墨II极的电极反应式为:___________ ;当石墨I极中有1molNO2参加反应时,石墨II极消耗的O2的体积___________ (标准状况下)。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,即可观察到铁钉附近的溶液出现蓝色沉淀,表明铁被
(2)装置2中的石墨作
(3)装置3为由NO2、O2、熔融盐NaNO3组成的燃料电池示意图。在使用过程中石墨I电极反应生成一种氧化物Y,则Y为
更新时间:2021-11-13 10:24:30
|
相似题推荐
【推荐1】(1)肼(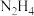 )-空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为
)-空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为_____________________ 。
(2)科研人员新近开发一种由甲醇和氧气为燃料,强碱溶液作电解质溶液的新型手机电池,可供手机连续使用一个月。则通入甲醇的是_______ 填(“正”或“负”)极,写出该电池的负极反应式:_____________________ 。
(3)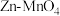 干电池应用广泛,电解质溶液是
干电池应用广泛,电解质溶液是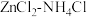 混合溶液。
混合溶液。
①该电池的负极材料是______ 。电池工作时,电子流向__________ 填(“正”或“负”)极。
②若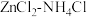 混合溶液中含有杂质
混合溶液中含有杂质 ,会加速某电极的腐蚀,其主要原因是
,会加速某电极的腐蚀,其主要原因是_______ 。
③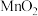 的生产方法之一是以石墨为电极,电解酸化的
的生产方法之一是以石墨为电极,电解酸化的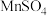 溶液。阳极的主要电极反应式是
溶液。阳极的主要电极反应式是_____________________ 。若电路中通过4mol电子,标准状况下产生气体的物质的量为_________ 。
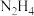 )-空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为
)-空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为(2)科研人员新近开发一种由甲醇和氧气为燃料,强碱溶液作电解质溶液的新型手机电池,可供手机连续使用一个月。则通入甲醇的是
(3)
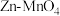 干电池应用广泛,电解质溶液是
干电池应用广泛,电解质溶液是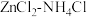 混合溶液。
混合溶液。①该电池的负极材料是
②若
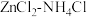 混合溶液中含有杂质
混合溶液中含有杂质 ,会加速某电极的腐蚀,其主要原因是
,会加速某电极的腐蚀,其主要原因是③
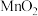 的生产方法之一是以石墨为电极,电解酸化的
的生产方法之一是以石墨为电极,电解酸化的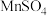 溶液。阳极的主要电极反应式是
溶液。阳极的主要电极反应式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题:
(1)高铁酸钾(K2FeO4)的还原产物常常是Fe(OH)3,常常用于水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置。试回答下列问题:
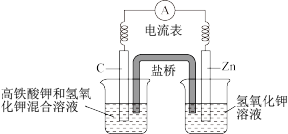
①该电池放电时正极的电极反应式为___________ ;
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向___________ (填“左”或“右”)移动。
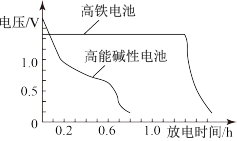
③上图为高铁电池和常用的高能碱性电池的放电曲线,由此可得高铁电池的优点有___________ 。
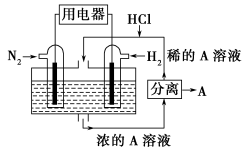
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式是___________ ,A是___________ 。
(1)高铁酸钾(K2FeO4)的还原产物常常是Fe(OH)3,常常用于水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置。试回答下列问题:

①该电池放电时正极的电极反应式为
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向

③上图为高铁电池和常用的高能碱性电池的放电曲线,由此可得高铁电池的优点有
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式是

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】某兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜的精炼原理,如图所示,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲中通入氧气的电极是____ 极(填“正”或“负”),通甲烷气体的电极反应式是______ 。
(2)乙装置中电解的总离子方程式为_______ ,阴极产物为_______ 。
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁极上生成的气体体积为_______ L;丙装置中阴极析出铜的质量为_______ g。

(1)甲中通入氧气的电极是
(2)乙装置中电解的总离子方程式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁极上生成的气体体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)有一种新型的高能电池—钠硫电池(熔融的钠、硫为两极,以Na+导电的βAl2O3陶瓷作固体电解质),反应式为2Na+xS Na2Sx。
Na2Sx。

①充电时,钠极与外电源________ (填“正”或“负”)极相连。其阳极反应式:_______________________________________ 。
②放电时,发生还原反应的是__________ (填“钠”或“硫”)极。
③用该电池作电源电解(如上图)NaCl溶液(足量),写出电解NaCl溶液的离子方程式:________________________________ ,若钠硫电池工作一段时间后消耗23 g Na (电能的损耗忽略不计),若要使溶液完全恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入(或通入)________ (填物质名称),其质量约为_____________________________________ 。
④若用该钠硫电池作电源在一铁片上镀铜,此铁片与__________ (填“钠”或“硫”)极相连。
(2)某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。

①放 电时,交换膜左侧溶液中实验现象
电时,交换膜左侧溶液中实验现象____________________ 。
②当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少__________ mol离子。
③该电池的能量转化的主要形式为_________________________________________________ 。
 Na2Sx。
Na2Sx。
①充电时,钠极与外电源
②放电时,发生还原反应的是
③用该电池作电源电解(如上图)NaCl溶液(足量),写出电解NaCl溶液的离子方程式:
④若用该钠硫电池作电源在一铁片上镀铜,此铁片与
(2)某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。

①放
 电时,交换膜左侧溶液中实验现象
电时,交换膜左侧溶液中实验现象②当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少
③该电池的能量转化的主要形式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__ 热反应,Ba(OH)2•8H2O与NH4Cl反应时,需要将固体研细其目的是_ 。反应过程__ (填“①”或“②”)的能量变化可用图表示。

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_ (填序号)。

(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中_ (填A或B)处电极入口通甲烷,当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为__ mol。

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为__ 。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的负极反应式为__ 。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是

(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的负极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】如图所示三套实验装置,分别回答下列问题。
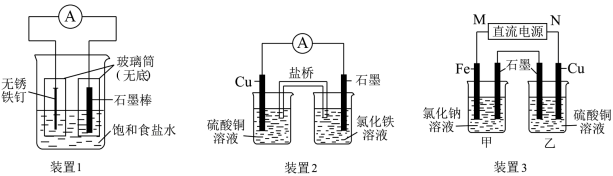
(1)装置1为铁的吸氧腐蚀实验.向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为___ 。
(2)装置2中发生的总反应的离子方程式为___ 。
(3)装置3中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液.反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为__ mL。
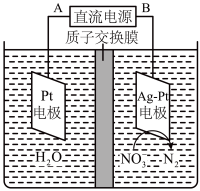
(4)电化学沉解法可用于治理水中硝酸盐的污染。电化学降解NO 的原理如图,阴极反应式为:
的原理如图,阴极反应式为:___ 。

(1)装置1为铁的吸氧腐蚀实验.向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为
(2)装置2中发生的总反应的离子方程式为
(3)装置3中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液.反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为
(4)电化学沉解法可用于治理水中硝酸盐的污染。电化学降解NO
 的原理如图,阴极反应式为:
的原理如图,阴极反应式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义。图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。
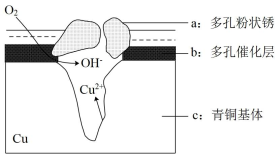
①腐蚀过程中,负极是_____ (填图中字母“a”或“b”或“c”)
②环境中的Clˉ̄扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为_____ ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_____ L(标准状况)。

①腐蚀过程中,负极是
②环境中的Clˉ̄扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】请用所学的化学知识解释下列反应。
(1)Ag2O-Zn-KOH 组成的纽扣电池,正极区 pH 增大,请用电极反应式解释:______________ 。
(2)炒过菜的铁锅不及时清洗(未洗净残液中含 NaCl),不久会生锈,写出正极电极反应 式:_____________ ,其锈蚀过程属于_____ (填“析氢腐蚀”或“吸氧腐蚀”)。
(3)CuO 中含 Fe2O3,要想用此化合物制得纯净的 CuCl2 固体涉及流程为:

①物质 a 为加入_____ 把 pH 调到_____ 。
②操作 c 为在_____ 条件下加热蒸干得固体 CuCl2。
(4)C2H6在足量 O2中完全燃烧,当转移 7 mol e-时放热 a kJ,写出表示 C2H6 燃烧热的热化学方程式:_____ 。
(5)CO2 中混有 HCl,可用饱和 NaHCO3 溶液吸收 HCl,请用平衡移动原理解释原因_____
(1)Ag2O-Zn-KOH 组成的纽扣电池,正极区 pH 增大,请用电极反应式解释:
(2)炒过菜的铁锅不及时清洗(未洗净残液中含 NaCl),不久会生锈,写出正极电极反应 式:
(3)CuO 中含 Fe2O3,要想用此化合物制得纯净的 CuCl2 固体涉及流程为:

| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 pH | 1.9 | 4.7 |
| 完全沉淀 pH | 3.2 | 6.7 |
①物质 a 为加入
②操作 c 为在
(4)C2H6在足量 O2中完全燃烧,当转移 7 mol e-时放热 a kJ,写出表示 C2H6 燃烧热的热化学方程式:
(5)CO2 中混有 HCl,可用饱和 NaHCO3 溶液吸收 HCl,请用平衡移动原理解释原因
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:

(1)电流从____ (选填“左”或“右”,下同)侧电极经过负载后流向______ 侧电极。
(2)为使电池持续放电,离子交换膜需选用______ 离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________ 。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________ 摩尔。
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出酒驾测定中电池总反应方程式:______________________________ ,负极反应方程式:____________________________ 。


(1)电流从
(2)为使电池持续放电,离子交换膜需选用
(3)A电极上的电极反应式为
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出酒驾测定中电池总反应方程式:

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。
I.原电池是化学对人类的一项重大贡献。实验室为研究原电池原理,将a和b用导线连接,设计如图装置。

(1)Cu电极为原电池_______ 极(填“正”或“负”),电极反应式为_______ 。
(2)溶液中 移向
移向_______ 极(填“Cu”或“Zn”)。
(3)若工作前两极质量相等,工作一段时间后,导线中通过了1mol电子,则两极的质量差为____ g。
II.将除锈后的铁钉(含有少量的碳)用饱和食盐水浸泡一下,放入下图所示的具支试管中。

(4)几分钟后,可观察到右边导管中的水柱____ (填“升高”或“降低”),水柱变化的原因是铁钉发生了电化学腐蚀,写出正极的电极反应式:____
III.(5)Li-CuO二次电池的比能量高、工作温度宽。Li-CuO二次电池中,金属锂作____ 极。比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣,则Li、Na、Al分别作为电极时比能量由大到小的顺序为____ 。
(6)锂硒电池具有优异的循环稳定性。

①一种锂硒电池放电时的工作原理如图1所示,正极的电极反应式为_______ 。
②Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是_______ 。
I.原电池是化学对人类的一项重大贡献。实验室为研究原电池原理,将a和b用导线连接,设计如图装置。

(1)Cu电极为原电池
(2)溶液中
 移向
移向(3)若工作前两极质量相等,工作一段时间后,导线中通过了1mol电子,则两极的质量差为
II.将除锈后的铁钉(含有少量的碳)用饱和食盐水浸泡一下,放入下图所示的具支试管中。

(4)几分钟后,可观察到右边导管中的水柱
III.(5)Li-CuO二次电池的比能量高、工作温度宽。Li-CuO二次电池中,金属锂作
(6)锂硒电池具有优异的循环稳定性。

①一种锂硒电池放电时的工作原理如图1所示,正极的电极反应式为
②Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】某原电池装置如图所示,装置中盐桥的作用是使整个装置形成一个闭合回路,电解质溶液足量,闭合开关,观察到电流计指针发生偏转,回答下列问题。

(1)该原电池工作过程中,电池的负极上的电极反应式为___________ ,石墨电极上发生了___________ (填“氧化”或“还原”)反应。
(2)该原电池工作时,下列说法正确的是___________ (填标号)。
a.电子移动的方向: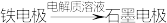
b.盐桥中的 会向右侧烧杯移动
会向右侧烧杯移动
c. 溶液的颜色会逐渐变浅
溶液的颜色会逐渐变浅
d.将KCl盐桥换成 盐桥,该装置不能长时间正常工作
盐桥,该装置不能长时间正常工作
(3)当铁电极减少28g时,外电路中转移的电子数目为___________  。
。
(4)原电池工作时能量转化形式为___________ ,根据原电池形成条件,下列反应理论上可以设计成原电池的是___________ (填标号)。
A. 与
与 的反应 B.KOH和HCl的反应
的反应 B.KOH和HCl的反应
C.Cu和 的反应 D.
的反应 D. 和
和 的反应
的反应

(1)该原电池工作过程中,电池的负极上的电极反应式为
(2)该原电池工作时,下列说法正确的是
a.电子移动的方向:
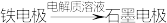
b.盐桥中的
 会向右侧烧杯移动
会向右侧烧杯移动c.
 溶液的颜色会逐渐变浅
溶液的颜色会逐渐变浅d.将KCl盐桥换成
 盐桥,该装置不能长时间正常工作
盐桥,该装置不能长时间正常工作(3)当铁电极减少28g时,外电路中转移的电子数目为
 。
。(4)原电池工作时能量转化形式为
A.
 与
与 的反应 B.KOH和HCl的反应
的反应 B.KOH和HCl的反应C.Cu和
 的反应 D.
的反应 D. 和
和 的反应
的反应
您最近一年使用:0次

 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。

