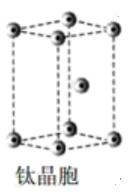
钛晶体中配位数为___________ ,

2021高三·全国·专题练习 查看更多[1]
(已下线)专题03 物构结构与性质之疑难杂症(2)-【微专题·大素养】备战2022年高考化学核心突破(选考模块)
更新时间:2021-12-24 18:57:06
|
【知识点】 金属晶体原子堆积模型解读
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】结合金属晶体的结构和性质,回答下列问题。
(1)已知下列金属晶体:Na、K、Fe、Cu、Mg、Zn、Au。
①属于体心立方密堆积的是_______ ;
②属于六方最密堆积的是_______ ;
③属于面心立方最密堆积的是_______ 。
(2)根据下列叙述,能判断一定为金属晶体的是_______ (填字母)。
A.由分子间作用力形成,熔点很低
B.由共价键结合形成网状晶体,熔点很高
C.固体有良好的导电性、导热性和延展性
(3)下列关于金属晶体的叙述正确的是_______ (填字母,双选)。
A.常温下,金属单质都以金属晶体的形式存在
B.金属阳离子与“自由电子”之间的强烈作用,在一定外力作用下,不因形变而消失
C.钙的熔、沸点高于钾
D.温度越高,金属的导电性越好
(1)已知下列金属晶体:Na、K、Fe、Cu、Mg、Zn、Au。
①属于体心立方密堆积的是
②属于六方最密堆积的是
③属于面心立方最密堆积的是
(2)根据下列叙述,能判断一定为金属晶体的是
A.由分子间作用力形成,熔点很低
B.由共价键结合形成网状晶体,熔点很高
C.固体有良好的导电性、导热性和延展性
(3)下列关于金属晶体的叙述正确的是
A.常温下,金属单质都以金属晶体的形式存在
B.金属阳离子与“自由电子”之间的强烈作用,在一定外力作用下,不因形变而消失
C.钙的熔、沸点高于钾
D.温度越高,金属的导电性越好
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】元素周期表中第ⅦA族包括氟、氯、溴、碘、砹五种元素,统称为卤素。其中代表元素氯富集在海水中,其单质及其化合物在生活、生产中有着广泛地应用。回答下列问题:
(1)基态氯原子能量最高能层上的原子轨道数为______ ;现代化学中,常用光谱分析来鉴定元素,这与原子的___________ 有关。
(2)物质的熔点与其结构密切相关。某同学判断某些卤化物的熔点为NaF>NaCl,SiF4<SiCl4。该同学的主要判断依据是___________ 。
(3)在氢卤酸中,HF是唯一的弱酸,主要原因是__________ 。
(4)光气(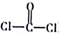 )用作有机合成、农药、药物、染料及其他化工制品的中间体。从电子云的重叠角度分析,该分子中含有的共价键类型是
)用作有机合成、农药、药物、染料及其他化工制品的中间体。从电子云的重叠角度分析,该分子中含有的共价键类型是_______ ,C原子的杂化方式为____ ,分子的空间构型为______ 。
(5)PtCl2(NH3)2为平面结构,可以形成甲、乙两种固体。其中,一种为淡黄色固体,在水中溶解度小;另一种为棕黄色固体,在水中溶解度大,是癌症治疗的常用化学药物。
① 棕黄色固体是图中的___ (填“甲”或“乙”),试解释它在水中的溶解度比淡黄色固体大的原因是___ 。
② Pt原子在三维空间里可按图 所示方式堆积形成金属Pt晶体:
该晶胞的堆积方式为____ ,M 原子的配位数为________ ,若该晶体的密度为ρg·cm3,阿伏伽德罗常数的值为NA,则Pt原子的原子半径为______ pm。
(1)基态氯原子能量最高能层上的原子轨道数为
(2)物质的熔点与其结构密切相关。某同学判断某些卤化物的熔点为NaF>NaCl,SiF4<SiCl4。该同学的主要判断依据是
(3)在氢卤酸中,HF是唯一的弱酸,主要原因是
(4)光气(
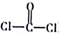 )用作有机合成、农药、药物、染料及其他化工制品的中间体。从电子云的重叠角度分析,该分子中含有的共价键类型是
)用作有机合成、农药、药物、染料及其他化工制品的中间体。从电子云的重叠角度分析,该分子中含有的共价键类型是(5)PtCl2(NH3)2为平面结构,可以形成甲、乙两种固体。其中,一种为淡黄色固体,在水中溶解度小;另一种为棕黄色固体,在水中溶解度大,是癌症治疗的常用化学药物。
① 棕黄色固体是图中的

② Pt原子在三维空间里可按图 所示方式堆积形成金属Pt晶体:
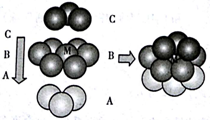
该晶胞的堆积方式为
您最近一年使用:0次
【推荐3】地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素。它们在化学中占有极其重要的地位。
(1)①Na、Mg、Al三种元素第一电离能由大到小的顺序为___________
②金属钠原子的堆积方式是体心立方,其配位数为___________
(2)选修三课本第42页实验2-2:向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
①硫酸铜溶液中呈___________ 色的物质是水合铜离子,请写出它的结构简式,并标明其中配位键___________
②请写出难溶物溶解得到深蓝色的透明溶液的离子方程式___________
③结构测定的实验证明,无论在氨水溶液中还是在晶体中,深蓝色都是由于存在某种离子,1mol该离子含有___________ molσ键。
(3)写出少量Na2O2与氯化铁溶液反应的离子反应方程式:___________ (要求:仅写1个总的离子方程式)
(1)①Na、Mg、Al三种元素第一电离能由大到小的顺序为
②金属钠原子的堆积方式是体心立方,其配位数为
(2)选修三课本第42页实验2-2:向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
①硫酸铜溶液中呈
②请写出难溶物溶解得到深蓝色的透明溶液的离子方程式
③结构测定的实验证明,无论在氨水溶液中还是在晶体中,深蓝色都是由于存在某种离子,1mol该离子含有
(3)写出少量Na2O2与氯化铁溶液反应的离子反应方程式:
您最近一年使用:0次



