现有mg含有Na2O杂质的Na2O2样品,某同学在实验室用如下装置(部分夹持仪器已省略)测定其杂质含量:
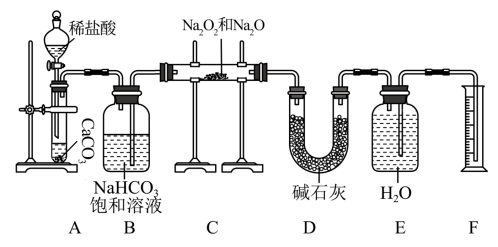
回答下列问题:
(1)装置A中反应的离子方程式为___________ ;该反应基本类型为___________ ,其中CaCO3属于___________ (填“酸”“碱”或“盐”)。
(2)图中有一处明显错误,请指出并改正:___________ 。
(3)装置B的作用是___________ ;装置D的作用是___________ ;若无装置D,样品中杂质的质量分数___________ (填“偏高”“偏低”或“无影响”)。
(4)写出装置C中Na2O2与CO2发生反应的化学方程式:___________ 。
(5)实验结束后,装置F中水的体积为V mL,已知氧气的密度为1.43 g· L-1,样品中杂质的质量分数为___________ (用含m、V的代数式表示,列出计算式即可)。

回答下列问题:
(1)装置A中反应的离子方程式为
(2)图中有一处明显错误,请指出并改正:
(3)装置B的作用是
(4)写出装置C中Na2O2与CO2发生反应的化学方程式:
(5)实验结束后,装置F中水的体积为V mL,已知氧气的密度为1.43 g· L-1,样品中杂质的质量分数为
更新时间:2022-01-18 17:05:42
|
【知识点】 探究物质组成或测量物质的含量解读
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氨气能与金属氧化物(MxOy)反应生成M、N2和H2O,根据测定出H2O的量可推出金属M的相对原子质量,某研究小组同学用下列装置进行相关实验探究。请回答下列问题:
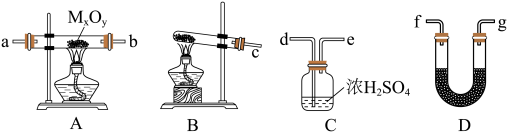
(1)按气流方向,正确的装置接口顺序为c→_________ (填序号,装置可重复使用)。
(2)装置D中盛放的药品名称为______ ,装置C的作用是_______ 。
(3)若实验中准确称取金属氧化物的质量为zg,完全反应后,测得D中生成水的质量为wg。则M的相对原子质量为_____ (用含x、y、z、w的式子表示)。
(4)某同学仔细分析上述装置后认为仍存在缺陷。你认为该如何改进:_________ .
(5)某同学用装置A、B、D以及装置E进行NH3的催化氧化实验研究,其中装置D盛放的药品为Na2O2。
①装置B中盛放的药品为________ .
②装置A中发生反应的化学方程式为_____________
③验证有NO生成的反应现象为_________ ,E中发生反应的化学方程式为____________


(1)按气流方向,正确的装置接口顺序为c→
(2)装置D中盛放的药品名称为
(3)若实验中准确称取金属氧化物的质量为zg,完全反应后,测得D中生成水的质量为wg。则M的相对原子质量为
(4)某同学仔细分析上述装置后认为仍存在缺陷。你认为该如何改进:
(5)某同学用装置A、B、D以及装置E进行NH3的催化氧化实验研究,其中装置D盛放的药品为Na2O2。
①装置B中盛放的药品为
②装置A中发生反应的化学方程式为
③验证有NO生成的反应现象为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】水合肼(N2H4∙H2O)是一种无色透明、具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4∙H2O+NaCl。回答下列问题:
实验一:制备NaClO溶液(实验装置如图所示)

(1)配制100mL 10 mol∙L-1的NaOH溶液时,所需玻璃仪器除量筒外还有_______ (填字母)。
A.玻璃棒 B.烧杯 C.烧瓶 D.干燥管 E.胶头滴管
(2)装置M的作用是_______ 。
实验二:制取水合肼(实验装置如图所示)
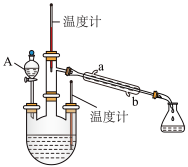
(3)①仪器A的名称为_______ ,冷凝管的水流方向为_______ 。
②反应过程中需控制反应温度,同时将A中溶液缓慢滴入三颈烧瓶中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学方程式:_______ ,A中盛装的溶液是_______ (填字母)。
A.CO(NH2)2溶液 B.NaOH和NaClO溶液
③充分反应后,加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中水合肼含量
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,取25.00mL该溶液置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在_______ (填“酸式”或“碱式”)滴定管中,本实验滴定终点的现象为_______ 。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4∙H2O)的质量分数为_______ 。
实验一:制备NaClO溶液(实验装置如图所示)

(1)配制100mL 10 mol∙L-1的NaOH溶液时,所需玻璃仪器除量筒外还有
A.玻璃棒 B.烧杯 C.烧瓶 D.干燥管 E.胶头滴管
(2)装置M的作用是
实验二:制取水合肼(实验装置如图所示)

(3)①仪器A的名称为
②反应过程中需控制反应温度,同时将A中溶液缓慢滴入三颈烧瓶中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学方程式:
A.CO(NH2)2溶液 B.NaOH和NaClO溶液
③充分反应后,加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中水合肼含量
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,取25.00mL该溶液置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4∙H2O)的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】稀土是一种重要的战略资源,我国稀土出口量世界第一。铈(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为CeCO3F)形式存在。工业上利用氟碳铈矿制取CeO2的一种工艺流程如图:
②在O2作用下,氟碳铈矿焙烧后的产物中有CeO2和CeF4;
③在硫酸体系中,Ce4+在[(HA)2]中的溶解度大于其在水中的溶解度,Ce3+与之相反。
回答下列问题:
(1)步骤Ⅰ“焙烧”过程中CeCO3F发生反应的化学方程式为____ 。
(2)步骤Ⅱ充分反应后经过滤,得到的水溶液中阳离子有____ 。
(3)步骤Ⅲ的操作名称是____ 。
(4)步骤Ⅳ中加入H2O2的目的是____ 。
(5)步骤Ⅴ中发生反应的离子方程式是____ 。
(6)取上述流程中得到的CeO2产品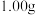 加硫酸溶解,可与50.0mL0.1mol/LFeSO4溶液恰好完全反应(铈元素被还原为Ce3+,其他杂质均不参与反应),该产品中CeO2的质量分数为
加硫酸溶解,可与50.0mL0.1mol/LFeSO4溶液恰好完全反应(铈元素被还原为Ce3+,其他杂质均不参与反应),该产品中CeO2的质量分数为____ 。(已知:CeO2的摩尔质量为172g/mol)

②在O2作用下,氟碳铈矿焙烧后的产物中有CeO2和CeF4;
③在硫酸体系中,Ce4+在[(HA)2]中的溶解度大于其在水中的溶解度,Ce3+与之相反。
回答下列问题:
(1)步骤Ⅰ“焙烧”过程中CeCO3F发生反应的化学方程式为
(2)步骤Ⅱ充分反应后经过滤,得到的水溶液中阳离子有
(3)步骤Ⅲ的操作名称是
(4)步骤Ⅳ中加入H2O2的目的是
(5)步骤Ⅴ中发生反应的离子方程式是
(6)取上述流程中得到的CeO2产品
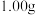 加硫酸溶解,可与50.0mL0.1mol/LFeSO4溶液恰好完全反应(铈元素被还原为Ce3+,其他杂质均不参与反应),该产品中CeO2的质量分数为
加硫酸溶解,可与50.0mL0.1mol/LFeSO4溶液恰好完全反应(铈元素被还原为Ce3+,其他杂质均不参与反应),该产品中CeO2的质量分数为
您最近一年使用:0次



