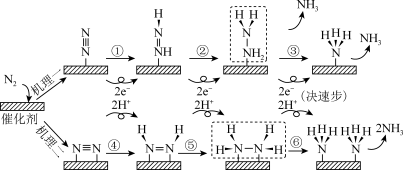
已知反应:
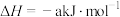 (a>0),其反应机理如下:
(a>0),其反应机理如下:
① 快;
快;
②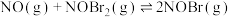 慢
慢
下列有关该反应的说法正确的是

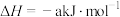 (a>0),其反应机理如下:
(a>0),其反应机理如下:①
 快;
快;②
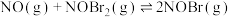 慢
慢下列有关该反应的说法正确的是
A.正反应的活化能比逆反应的活化能大 |
B.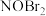 是该反应的催化剂 是该反应的催化剂 |
| C.该反应的速率主要取决于②的快慢 |
D.增大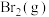 浓度能增大活化分子百分数,加快反应速率 浓度能增大活化分子百分数,加快反应速率 |
21-22高一下·辽宁鞍山·期中 查看更多[3]
(已下线)专题03 化学反应速率与化学平衡(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)(已下线)2.3.3 化学反应速率综合分析-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)辽宁省鞍山市第一中学2021-2022学年高一下学期期中考试化学试题
更新时间:2022-05-16 18:33:27
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】工业上,可采用还原法处理尾气中NO,其原理:2NO(g)+2H2(g) N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
下列有关推断正确的是
 N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:| 实验 | c(NO)/mol·L-1 | c(H2)/mol·L-1 | v(正)/mol·L-1·min-1 |
| ① | 0.10 | 0.10 | 0.414k |
| ② | 0.10 | 0.40 | 1.656k |
| ③ | 0.20 | 0.10 | 1.656k |
| A.上述反应中,正反应活化能大于逆反应活化能 |
| B.若升高温度,则k(正)增大,k(逆)减小 |
| C.在上述反应中,反应级数:m=2,n=1 |
| D.在一定温度下,NO、H2的浓度对正反应速率影响程度相同 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】100mL 1.0mol/L H2SO4 跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A.碳酸钠固体 | B.醋酸钠固体 | C.硫酸钠固体 | D.硝酸钾溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知分解1molH2O2放出热量98kJ。在含少量I-的溶液中,H2O2分解的机理为:
①H2O2+I-→H2O+IO- 慢 ②H2O2+IO-→H2O+O2+I- 快
下列有关该反应的说法正确的是
①H2O2+I-→H2O+IO- 慢 ②H2O2+IO-→H2O+O2+I- 快
下列有关该反应的说法正确的是
| A.反应活化能等于98kJ/mol | B.反应速率由②决定 |
| C.I﹣是该反应的催化剂 | D.v(H2O2)=v(H2O)=v(O2) |
您最近一年使用:0次
【推荐2】下列关于化学反应原理基础知识的叙述中,正确的是
| A.使用催化剂可以改变反应的活化能,但不会改变反应的焓变。 |
| B.对于已经达到平衡的化学反应,改变压强,平衡常数(K)可能改变 |
| C.强电解质水溶液的导电性一定比弱电解质水溶液的导电性强 |
| D.电解饱和食盐水,阳极产物一定是氯气 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】反应
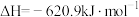 分三步进行,各步的相对能量变化如图I、II、III所示:
分三步进行,各步的相对能量变化如图I、II、III所示:不正确 的是

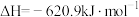 分三步进行,各步的相对能量变化如图I、II、III所示:
分三步进行,各步的相对能量变化如图I、II、III所示: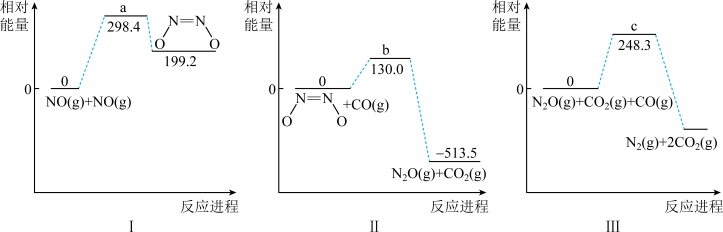
| A.三步分反应中决定总反应速率的是反应I |
B.I、II两步的总反应为 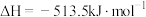 |
| C.根据图像无法判断过渡状态a、b、c的稳定性相对高低 |
D.反应III逆反应的活化能 (逆) (逆) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】 催化某反应的机理如题8图所示(·OH表示羟基自由基)。下列叙述
催化某反应的机理如题8图所示(·OH表示羟基自由基)。下列叙述不正确 的是
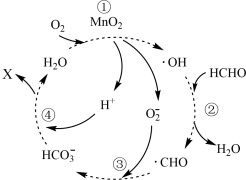
 催化某反应的机理如题8图所示(·OH表示羟基自由基)。下列叙述
催化某反应的机理如题8图所示(·OH表示羟基自由基)。下列叙述
A.反应①为 |
B.·OH与HCHO的反应速率快于 与HCHO的 与HCHO的 |
C.反应④生成的物质X是 |
D.理论上反应消耗的HCHO与 的物质的量之比为1:1 的物质的量之比为1:1 |
您最近一年使用:0次


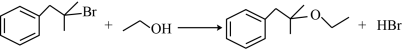 的能量与反应历程如图所示。下列说法正确的是
的能量与反应历程如图所示。下列说法正确的是
 的两种途径反应机理如图所示,下列说法不正确的是
的两种途径反应机理如图所示,下列说法不正确的是