立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。成品中S2−的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取25.00mL0.1000mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000mol·L−1Na2S2O3溶液滴定,反应式为I2+2 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为_______ 。
 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为
2022高三·全国·专题练习 查看更多[1]
(已下线)专题4 滴定终点专练
更新时间:2022-06-08 06:52:08
|
【知识点】 酸碱中和滴定原理的应用解读
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应的离子方程式是:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
回答下列问题:
(1)用________ (填“酸”或“碱”)式滴定管盛放高锰酸钾溶液;
(2)该滴定实验选用何种指示剂,说明理由____________________ (如无需加入指示剂也请说明理由);
(3)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则根据(b-a)mL计算得到的待测浓度,比实际浓度________ (填“大”或“小”)。
回答下列问题:
(1)用
(2)该滴定实验选用何种指示剂,说明理由
(3)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则根据(b-a)mL计算得到的待测浓度,比实际浓度
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】以碳酸镁(含少量 )为原料制取硫酸镁晶体,并测定
)为原料制取硫酸镁晶体,并测定 含量:将原料完全溶于一定量的稀硫酸中,加足量的
含量:将原料完全溶于一定量的稀硫酸中,加足量的 后用
后用 调节溶液的
调节溶液的 ,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
(1)
 的稀硫酸至少能溶解原料的质量为
的稀硫酸至少能溶解原料的质量为______ 。
(2)加 调节
调节 促进
促进 水解,写出总反应的离子方程式为
水解,写出总反应的离子方程式为______ 。
(3)已知: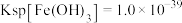 ,
,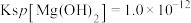 。室温下,若溶液中
。室温下,若溶液中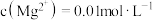 ,欲使溶液中的
,欲使溶液中的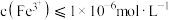 ,需调节溶液
,需调节溶液 范围为
范围为______ 。
(4)常采用下列方法测定结晶硫酸镁中 的含量:
的含量:
已知:①在 为9~10时,
为9~10时, 、
、 均能与
均能与 形成配合物
形成配合物
②在 为5~6时,
为5~6时, 除了与
除了与 反应,还能将
反应,还能将 与
与 形成的配合物中的
形成的配合物中的 “置换”出来:
“置换”出来: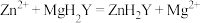
步骤1:准确称取得到的硫酸镁晶体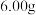 加入过量的
加入过量的 ,配成
,配成
 在9~10之间溶液
在9~10之间溶液
步骤2:准确移取 溶液
溶液 于锥形瓶中,用
于锥形瓶中,用 标准溶液滴定,滴定到终点,消耗标准溶液的体积为
标准溶液滴定,滴定到终点,消耗标准溶液的体积为
步骤3:准确移取 溶液
溶液 于另一只锥形瓶中,调节
于另一只锥形瓶中,调节 在5~6;用
在5~6;用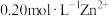 标准溶液滴定,滴定至终点,消耗
标准溶液滴定,滴定至终点,消耗 标准溶液的体积为
标准溶液的体积为 。
。
计算该结晶硫酸镁中 的质量分数(请给出计算过程)。
的质量分数(请给出计算过程)。____________ 。
 )为原料制取硫酸镁晶体,并测定
)为原料制取硫酸镁晶体,并测定 含量:将原料完全溶于一定量的稀硫酸中,加足量的
含量:将原料完全溶于一定量的稀硫酸中,加足量的 后用
后用 调节溶液的
调节溶液的 ,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。(1)

 的稀硫酸至少能溶解原料的质量为
的稀硫酸至少能溶解原料的质量为(2)加
 调节
调节 促进
促进 水解,写出总反应的离子方程式为
水解,写出总反应的离子方程式为(3)已知:
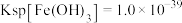 ,
,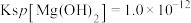 。室温下,若溶液中
。室温下,若溶液中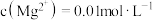 ,欲使溶液中的
,欲使溶液中的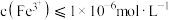 ,需调节溶液
,需调节溶液 范围为
范围为(4)常采用下列方法测定结晶硫酸镁中
 的含量:
的含量:已知:①在
 为9~10时,
为9~10时, 、
、 均能与
均能与 形成配合物
形成配合物②在
 为5~6时,
为5~6时, 除了与
除了与 反应,还能将
反应,还能将 与
与 形成的配合物中的
形成的配合物中的 “置换”出来:
“置换”出来: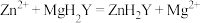
步骤1:准确称取得到的硫酸镁晶体
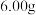 加入过量的
加入过量的 ,配成
,配成
 在9~10之间溶液
在9~10之间溶液
步骤2:准确移取
 溶液
溶液 于锥形瓶中,用
于锥形瓶中,用 标准溶液滴定,滴定到终点,消耗标准溶液的体积为
标准溶液滴定,滴定到终点,消耗标准溶液的体积为
步骤3:准确移取
 溶液
溶液 于另一只锥形瓶中,调节
于另一只锥形瓶中,调节 在5~6;用
在5~6;用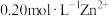 标准溶液滴定,滴定至终点,消耗
标准溶液滴定,滴定至终点,消耗 标准溶液的体积为
标准溶液的体积为 。
。计算该结晶硫酸镁中
 的质量分数(请给出计算过程)。
的质量分数(请给出计算过程)。
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式_______ 。
(2)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________ ,滴定操作时使用的指示剂是__________ ,该样品中Na2S2O5的残留量为____________ g·L-1(以SO2计)。
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式
(2)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为
您最近一年使用:0次



