生物柴油是指由动植物油脂(脂肪酸甘油三酯)与醇(甲醇或乙醇)经酯交换反应得到的脂肪酸单烷基酯,是可以替代普通柴油使用的清洁的可再生能源。利用地沟油与甲醇制备生物柴油,其原理和装置图(加热和夹持装置略)及实验步骤如下:
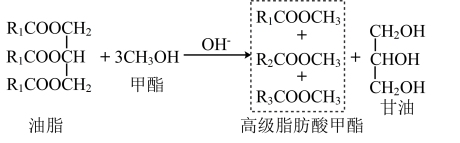
①称取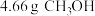 和
和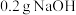 依次放入锥形瓶中,充分振荡得
依次放入锥形瓶中,充分振荡得 甲醇溶液;
甲醇溶液;
②将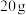 地沟油、
地沟油、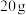 正己烷(作为溶剂)、步骤①配得的
正己烷(作为溶剂)、步骤①配得的 甲醇溶液一次加入三颈烧瓶中;
甲醇溶液一次加入三颈烧瓶中;
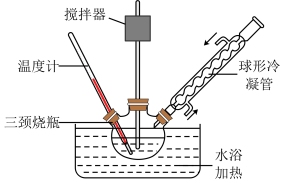
③安装装置(如图),恒温水浴加热,使温度保持在 左右,搅拌速度
左右,搅拌速度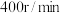 ,加热
,加热 ;
;
④冷却、分液、水洗、回收溶剂并得到生物柴油。
回答下列问题:
(1)实验巾 的用量不宜过多,其原因是
的用量不宜过多,其原因是_______ 。
(2)步骤④的液体分为两层,上层为生物柴油、正己烷和甲醇,上层液体需用温水洗涤,检验已洗涤干净的方法是_______ 。
(3)碘值是指每 油脂所能吸收
油脂所能吸收 的质量。测定产品碘值的步骤如下:
的质量。测定产品碘值的步骤如下:
I.准确称取mg油脂,注入碘量瓶中,向碘量瓶中加入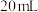 氯仿溶解后,加入
氯仿溶解后,加入 韦氏碘液(
韦氏碘液(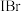 溶液及催化剂,发生反应:
溶液及催化剂,发生反应: ),立即加塞,摇匀后,将碘量瓶放于黑暗处。
),立即加塞,摇匀后,将碘量瓶放于黑暗处。
Ⅱ.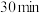 后立即加入
后立即加入 的碘化钾溶液和
的碘化钾溶液和 水,发生反应的化学方程式为
水,发生反应的化学方程式为_______ ,不断振荡,用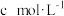 的
的 溶液滴定至溶液呈浅黄色时,加入
溶液滴定至溶液呈浅黄色时,加入 淀粉指示剂,继续滴定(
淀粉指示剂,继续滴定( ),至终点时消耗
),至终点时消耗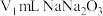 溶液。滴定终点的现象是
溶液。滴定终点的现象是_______ 。


①称取
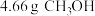 和
和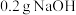 依次放入锥形瓶中,充分振荡得
依次放入锥形瓶中,充分振荡得 甲醇溶液;
甲醇溶液;②将
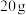 地沟油、
地沟油、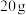 正己烷(作为溶剂)、步骤①配得的
正己烷(作为溶剂)、步骤①配得的 甲醇溶液一次加入三颈烧瓶中;
甲醇溶液一次加入三颈烧瓶中;③安装装置(如图),恒温水浴加热,使温度保持在
 左右,搅拌速度
左右,搅拌速度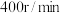 ,加热
,加热 ;
;④冷却、分液、水洗、回收溶剂并得到生物柴油。
回答下列问题:
(1)实验巾
 的用量不宜过多,其原因是
的用量不宜过多,其原因是(2)步骤④的液体分为两层,上层为生物柴油、正己烷和甲醇,上层液体需用温水洗涤,检验已洗涤干净的方法是
(3)碘值是指每
 油脂所能吸收
油脂所能吸收 的质量。测定产品碘值的步骤如下:
的质量。测定产品碘值的步骤如下:I.准确称取mg油脂,注入碘量瓶中,向碘量瓶中加入
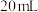 氯仿溶解后,加入
氯仿溶解后,加入 韦氏碘液(
韦氏碘液(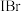 溶液及催化剂,发生反应:
溶液及催化剂,发生反应: ),立即加塞,摇匀后,将碘量瓶放于黑暗处。
),立即加塞,摇匀后,将碘量瓶放于黑暗处。Ⅱ.
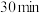 后立即加入
后立即加入 的碘化钾溶液和
的碘化钾溶液和 水,发生反应的化学方程式为
水,发生反应的化学方程式为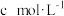 的
的 溶液滴定至溶液呈浅黄色时,加入
溶液滴定至溶液呈浅黄色时,加入 淀粉指示剂,继续滴定(
淀粉指示剂,继续滴定( ),至终点时消耗
),至终点时消耗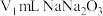 溶液。滴定终点的现象是
溶液。滴定终点的现象是
21-22高二·全国·课时练习 查看更多[3]
更新时间:2022-08-23 20:14:43
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】乙二酸是一种有机酸,俗名草酸,化学式为H2C2O4,广泛分布于植物、动物和真菌体中,常温下,用pH试纸测得0.2mol/L的H2C2O4溶液的pH=3。
(1)乙二酸的电离方程式为_____ 。
(2)测定血液样品中Ca2+的浓度。取血液样品50.00mL,加适量的草酸铵[(NH4)2C2O4]溶液可析出CaC2O4沉淀,将洗涤后的CaC2O4沉淀溶于强酸可得H2C2O4,将H2C2O4溶液稀释成250mL。再用0.010mol/L酸性KMnO4溶液进行滴定。
①滴定过程中操作滴定管的图示正确的是_____ 。______ 。
③如图是第一次滴定结束时滴定管中的液面,读数为a=_____ mL。
滴定时MnO 被还原为Mn2+的离子方程式为
被还原为Mn2+的离子方程式为_____ 。计算血液样品中Ca2+的浓度为_____ mol/L。
⑤下列操作可能造成测得的Ca2+浓度偏高的是_____ 。
A.滴定前平视,滴定后俯视 B.滴定管未润洗即装入标准液
B.滴定过程中锥形瓶中不慎有液体溅出 D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
(3)根据氧化还原滴定还可以根据沉淀原理滴定,即滴定剂与被滴定物生成的沉淀比滴定剂与指示剂生成的沉淀更难溶,且二者之间有明显的颜色差别。
参考表中的数据,若用AgNO3溶液滴定NaCl溶液,可选用的指示剂是_____ 溶液(填标号)。
(1)乙二酸的电离方程式为
(2)测定血液样品中Ca2+的浓度。取血液样品50.00mL,加适量的草酸铵[(NH4)2C2O4]溶液可析出CaC2O4沉淀,将洗涤后的CaC2O4沉淀溶于强酸可得H2C2O4,将H2C2O4溶液稀释成250mL。再用0.010mol/L酸性KMnO4溶液进行滴定。
①滴定过程中操作滴定管的图示正确的是
A.  B.
B.
③如图是第一次滴定结束时滴定管中的液面,读数为a=

| 滴定次数 | 草酸溶液体积(mL) | 标准液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.60 | a |
| 第二次 | 25.00 | 0.10 | 24.10 |
| 第三次 | 25.00 | 1.20 | 25.20 |
 被还原为Mn2+的离子方程式为
被还原为Mn2+的离子方程式为⑤下列操作可能造成测得的Ca2+浓度偏高的是
A.滴定前平视,滴定后俯视 B.滴定管未润洗即装入标准液
B.滴定过程中锥形瓶中不慎有液体溅出 D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
(3)根据氧化还原滴定还可以根据沉淀原理滴定,即滴定剂与被滴定物生成的沉淀比滴定剂与指示剂生成的沉淀更难溶,且二者之间有明显的颜色差别。
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白色 | 浅黄色 | 白色 | 砖红色 | 白色 |
| Ksp | 1.8×10-10 | 5.35×10-13 | 1.21×10-16 | 2.0×10-12 | 1.0×10-12 |
| A.NaBr | B.NaCN | C.Na2CrO4 | D.NaSCN |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】为测试一铁片中铁元素的含量,某课外活动小组提出下面方案并进行了实验。将0.200g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用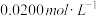 的
的 溶液滴定,达到终点时消耗了
溶液滴定,达到终点时消耗了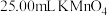 溶液。
溶液。
(1)配平以下方程式并标出电子转移的方向与数目____________________ 。
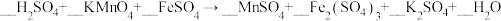
(2)滴定到终点时的现象为____________________ ,铁片中铁元素的质量分数为_______________________ 。
(3)高锰酸钾溶液往往用硫酸酸化而不用盐酸酸化,原因是:_____________ 。
(4) 溶液呈酸性,加硫酸后
溶液呈酸性,加硫酸后 增加,请结合离子方程式并利用化学平衡移动理论解释:
增加,请结合离子方程式并利用化学平衡移动理论解释:_____________________________ 。
(5)高锰酸钾在化学品生产中,广泛用作为氧化剂。可以氧化 、
、 、
、 、
、 等多种物质,如
等多种物质,如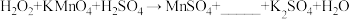 ,试推测空格上应填物质的化学式为
,试推测空格上应填物质的化学式为________ 。
(6)上述反应在恒温下进行,该过程中会明显看到先慢后快的反应,原因可能是____________________ 。
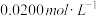 的
的 溶液滴定,达到终点时消耗了
溶液滴定,达到终点时消耗了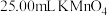 溶液。
溶液。(1)配平以下方程式并标出电子转移的方向与数目
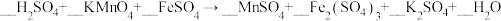
(2)滴定到终点时的现象为
(3)高锰酸钾溶液往往用硫酸酸化而不用盐酸酸化,原因是:
(4)
 溶液呈酸性,加硫酸后
溶液呈酸性,加硫酸后 增加,请结合离子方程式并利用化学平衡移动理论解释:
增加,请结合离子方程式并利用化学平衡移动理论解释:(5)高锰酸钾在化学品生产中,广泛用作为氧化剂。可以氧化
 、
、 、
、 、
、 等多种物质,如
等多种物质,如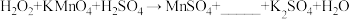 ,试推测空格上应填物质的化学式为
,试推测空格上应填物质的化学式为(6)上述反应在恒温下进行,该过程中会明显看到先慢后快的反应,原因可能是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)____ I-+____ IO3—+____ H+ =____ I2+____ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的化学方程式是:____________________________ 。
②某学生设计回收四氯化碳的操作为:a.加入适量Na2SO3稀溶液; b.分离出下层液体;c.将碘的四氯化碳溶液置于分液漏斗中; d.将分液漏斗充分振荡后静置。其中分液漏斗使用前须进行的操作是_______ ,上述操作正确的顺序是:_______ (填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取ag食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______________________ 。
②b中反应所消耗的KI的物质的量是____________ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)_____ mg/kg。
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的化学方程式是:
②某学生设计回收四氯化碳的操作为:a.加入适量Na2SO3稀溶液; b.分离出下层液体;c.将碘的四氯化碳溶液置于分液漏斗中; d.将分液漏斗充分振荡后静置。其中分液漏斗使用前须进行的操作是
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取ag食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②b中反应所消耗的KI的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】A、B两瓶液体,一瓶是植物油,一瓶是矿物油。现各取少量,放在两支洁净的试管里,加入NaOH溶液并加热,冷却后加水振荡静置,A出现泡沫,B无泡沫且分为两层。
由此可推出,A为________ ,B为________ 。
理由是________________________________ 。
由此可推出,A为
理由是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】正误判断
1.糖类化合物也称为碳水化合物。(_______)
2.蛋白质是仅由碳、氢、氧元素组成的物质。(_______)
3.糖类、油脂、蛋白质在一定条件下都能发生水解反应。(_______)
4.蔗糖、淀粉、油脂及其水解产物中均既有电解质也有非电解质。(_______)
5.油脂在酸性或碱性条件下,均可发生水解反应,且产物相同。(_______)
6.淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖。(_______)
7.纤维素在人体内可水解为葡萄糖,故可用做人体的营养物质。(_______)
8.淀粉和纤维素的通式均为(C6H10O5)n,两者互为同分异构体。(_______)
9.淀粉、纤维素和油脂都属于天然高分子化合物。(_______)
10.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体。(_______)
11.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O。(_______)
12.植物油氢化过程中发生了加成反应。(_______)
13.向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,未出现银镜,则蔗糖未水解。(_______)
14.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸。(_______)
1.糖类化合物也称为碳水化合物。(_______)
2.蛋白质是仅由碳、氢、氧元素组成的物质。(_______)
3.糖类、油脂、蛋白质在一定条件下都能发生水解反应。(_______)
4.蔗糖、淀粉、油脂及其水解产物中均既有电解质也有非电解质。(_______)
5.油脂在酸性或碱性条件下,均可发生水解反应,且产物相同。(_______)
6.淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖。(_______)
7.纤维素在人体内可水解为葡萄糖,故可用做人体的营养物质。(_______)
8.淀粉和纤维素的通式均为(C6H10O5)n,两者互为同分异构体。(_______)
9.淀粉、纤维素和油脂都属于天然高分子化合物。(_______)
10.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体。(_______)
11.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O。(_______)
12.植物油氢化过程中发生了加成反应。(_______)
13.向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,未出现银镜,则蔗糖未水解。(_______)
14.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸。(_______)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】有机物的性质与其所具有的官能团直接相关,辨析有机物的官能团,运用官能团的性质分析、理解有机物发生的反应是掌握有机物的金钥匙。某有机化合物A的结构简式为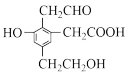 ,回答下列问题:
,回答下列问题:
(1)A中含有的官能团名称分别有_______ ,下列反应中①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦还原,其中A可以发生的有_______ 填字母序号)
a.①②③④⑤⑥⑦ b.①③④⑤⑦ c.①③④⑤⑥⑦ d.②③④⑤⑥
(2)取一定量Na、NaOH、NaHCO3分别与等物质的量A充分反应,则消耗Na、NaOH、NaHCO3三种物质的物质的量之比为_______
(3)A与足量Na2CO3反应所得有机产物的结构简式是_______ 。
某种兴奋剂的结构简式如图所示,回答下列问题:
 。
。
(4)该兴奋剂与FeCl3溶液混合,现象是_______ 。
(5)滴入KMnO4酸性溶液,振荡,紫色褪去,并不能证明其结构中含有碳碳双键,理由是_______ ,下列证明其结构中含有碳碳双键的方法中,合理且简单易行的是_______ 。
A.加入浓溴水,溴水褪色
B.先加入足量NaOH溶液再加入浓溴水,溴水褪色
C.先加入足量NaOH溶液再加入酸性KMnO4溶液,溶液褪色
D.先滴加NaOH溶液到刚好反应,再加入溴水,溴水褪色
(6)1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为_______ mol和_______ mol。
EPA(二十碳五烯酸)、DPA(二十二碳五烯酸)、DHA(二十二碳六烯酸,常称脑黄金)是不饱和程度大的长链脂肪酸(即高级脂肪酸),属于ω-3不饱和脂肪酸,是人体大脑发育、成长的重要物质,结构简式如下图。它们与甘油形成的酯是油脂的成分之一:

回答下列问题:
(7)关于EPA、DPA、DHA的下列说法中,错误的是_______。
(8)油脂在人体新陈代谢中发挥着重要的作用。有关油脂的说法错误的是_______。
(9)“深海鱼油”含较丰富的DHA甘油酯,请结合结构解释“深海鱼油”为什么一般做成胶囊状_______ 。
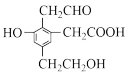 ,回答下列问题:
,回答下列问题:(1)A中含有的官能团名称分别有
a.①②③④⑤⑥⑦ b.①③④⑤⑦ c.①③④⑤⑥⑦ d.②③④⑤⑥
(2)取一定量Na、NaOH、NaHCO3分别与等物质的量A充分反应,则消耗Na、NaOH、NaHCO3三种物质的物质的量之比为
(3)A与足量Na2CO3反应所得有机产物的结构简式是
某种兴奋剂的结构简式如图所示,回答下列问题:
 。
。(4)该兴奋剂与FeCl3溶液混合,现象是
(5)滴入KMnO4酸性溶液,振荡,紫色褪去,并不能证明其结构中含有碳碳双键,理由是
A.加入浓溴水,溴水褪色
B.先加入足量NaOH溶液再加入浓溴水,溴水褪色
C.先加入足量NaOH溶液再加入酸性KMnO4溶液,溶液褪色
D.先滴加NaOH溶液到刚好反应,再加入溴水,溴水褪色
(6)1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为
EPA(二十碳五烯酸)、DPA(二十二碳五烯酸)、DHA(二十二碳六烯酸,常称脑黄金)是不饱和程度大的长链脂肪酸(即高级脂肪酸),属于ω-3不饱和脂肪酸,是人体大脑发育、成长的重要物质,结构简式如下图。它们与甘油形成的酯是油脂的成分之一:

回答下列问题:
(7)关于EPA、DPA、DHA的下列说法中,错误的是_______。
| A.EPA与DPA互为同系物 | B.DPA与DHA互为同分异构体 |
| C.EPA的分子式为C20H30O2 | D.DHA的甘油酯常温下为液态 |
(8)油脂在人体新陈代谢中发挥着重要的作用。有关油脂的说法错误的是_______。
| A.油脂的水解叫皂化反应 |
| B.天然油脂大多为混甘油酯 |
| C.硬脂酸(C17H35COOH)甘油酯沸点可能比DPA甘油酯高 |
| D.油脂的主要成分是高级脂肪酸的甘油酯,属于酯类 |
(9)“深海鱼油”含较丰富的DHA甘油酯,请结合结构解释“深海鱼油”为什么一般做成胶囊状
您最近一年使用:0次



