某校化学活动社团为测定1mol/L的H2SO4溶液与锌粒和锌粉反应的速率,设计如图1装置。
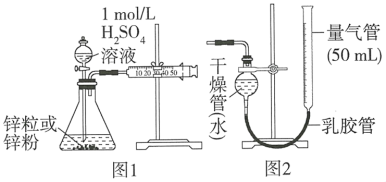
(1)图1中盛有H2SO4溶液的仪器名称是_______ 。
(2)按照图1装置实验时,限定了两次实验时间均为10min,还需要测定的另一个数据是_______ 。
(3)若将图1装置中的气体收集装置改为图2装置,实验完毕待冷却后,该学生准备读取量气管上液面所在处的刻度,发现量气管中液面高于干燥管中液面,应首先采取的操作是_______ 。

(1)图1中盛有H2SO4溶液的仪器名称是
(2)按照图1装置实验时,限定了两次实验时间均为10min,还需要测定的另一个数据是
(3)若将图1装置中的气体收集装置改为图2装置,实验完毕待冷却后,该学生准备读取量气管上液面所在处的刻度,发现量气管中液面高于干燥管中液面,应首先采取的操作是
更新时间:2022-09-04 20:54:00
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2(2%和5%两种浓度)分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:图甲可通过观察_______ 定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_______ 。

(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为______ ,检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看______ ,实验中需要测量的数据是______ 。
(3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如丙图所示。由D到A过程中,随着反应的进行反应速率逐渐______ (填“加快”或“减慢”),其变化的原因是______ 。(选填字母编号)

A.改变了反应的活化能
B.改变活化分子百分比
C.改变了反应途径
D.改变单位体积内的分子总数
(4)另一小组同学为了研究浓度对反应速率的影响,设计了如下实验设计方案,请帮助完成(所有空均需填满)。
可得到的结论是浓度越大,H2O2分解速率越快。
(1)定性分析:图甲可通过观察

(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为
(3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如丙图所示。由D到A过程中,随着反应的进行反应速率逐渐

A.改变了反应的活化能
B.改变活化分子百分比
C.改变了反应途径
D.改变单位体积内的分子总数
(4)另一小组同学为了研究浓度对反应速率的影响,设计了如下实验设计方案,请帮助完成(所有空均需填满)。
| 实验编号 | T/K | 催化剂 | 浓度 |
| 实验1 | 298 | 3滴FeCl3溶液 | 10mL2%H2O2 |
| 实验2 | 298 |
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】某实验小组对 分解速率的影响因素做了如下探究:
分解速率的影响因素做了如下探究:
Ⅰ 甲同学依据实验①和实验②所得数据进行处理得图1曲线;乙同学依据实验③和实验④所得数据进行处理得图2曲线。
甲同学依据实验①和实验②所得数据进行处理得图1曲线;乙同学依据实验③和实验④所得数据进行处理得图2曲线。
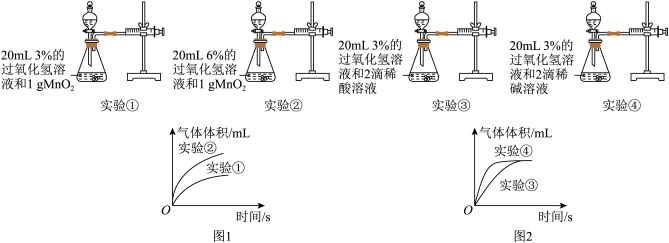
(1)由图1可知:该因素对过氧化氢分解速率的影响是_________ 。
(2)分析图2,可得出的结论是_________ 。
Ⅱ 丙同学设计了几组实验,探究
丙同学设计了几组实验,探究 影响分解速率的其他因素,记录数据如表。已知表中“时间
影响分解速率的其他因素,记录数据如表。已知表中“时间 ”表示用
”表示用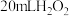 制取
制取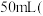 常温常压下
常温常压下 所需的时间
所需的时间
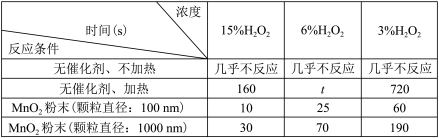
(3)推测时间t的范围为___________ 。
(4)写出上述实验中发生反应的化学方程式:_____________ 。
(5)实验结果表明,催化剂的催化效果与__________ 有关。
 分解速率的影响因素做了如下探究:
分解速率的影响因素做了如下探究:Ⅰ
 甲同学依据实验①和实验②所得数据进行处理得图1曲线;乙同学依据实验③和实验④所得数据进行处理得图2曲线。
甲同学依据实验①和实验②所得数据进行处理得图1曲线;乙同学依据实验③和实验④所得数据进行处理得图2曲线。
(1)由图1可知:该因素对过氧化氢分解速率的影响是
(2)分析图2,可得出的结论是
Ⅱ
 丙同学设计了几组实验,探究
丙同学设计了几组实验,探究 影响分解速率的其他因素,记录数据如表。已知表中“时间
影响分解速率的其他因素,记录数据如表。已知表中“时间 ”表示用
”表示用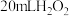 制取
制取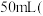 常温常压下
常温常压下 所需的时间
所需的时间
(3)推测时间t的范围为
(4)写出上述实验中发生反应的化学方程式:
(5)实验结果表明,催化剂的催化效果与
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】某化学兴趣小组设计实验探究反应速率的测定和比较。
[实验步骤]
Ⅰ.取一套装置(装置如下图所示),加入40mL1mol/L的硫酸,测量收集10mLH2所需的时间。
Ⅱ.取另一套装置,加入40mL1mol/L的硫酸,测量收集10mLH2所需的时间。

(1)[实验现象]
锌跟硫酸反应产生气泡,收集10mL气体, Ⅱ所用时间比Ⅰ所用时间_____ 。
(2)[实验结论]
4mol/L硫酸与锌反应比1mol/L硫酸与锌反应速率____ 。
(3)[注意事项]
a.锌粒的颗粒(即表面积)大小_____ ;
b.40mL硫酸要迅速加入;
c.装置____ ,且计时要迅速、准确;
d.气体收集可以用排水量气装置代替。
(4)实验讨论]除本实验测定反应速率的方法外,可行的方案还有(填两条):
a.________ ;b._______ 。
[实验步骤]
Ⅰ.取一套装置(装置如下图所示),加入40mL1mol/L的硫酸,测量收集10mLH2所需的时间。
Ⅱ.取另一套装置,加入40mL1mol/L的硫酸,测量收集10mLH2所需的时间。

(1)[实验现象]
锌跟硫酸反应产生气泡,收集10mL气体, Ⅱ所用时间比Ⅰ所用时间
(2)[实验结论]
4mol/L硫酸与锌反应比1mol/L硫酸与锌反应速率
(3)[注意事项]
a.锌粒的颗粒(即表面积)大小
b.40mL硫酸要迅速加入;
c.装置
d.气体收集可以用排水量气装置代替。
(4)实验讨论]除本实验测定反应速率的方法外,可行的方案还有(填两条):
a.
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】某化学自主实验小组通过实验探究NO2、NH3的性质
探究I:利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持及固定装置略去)。
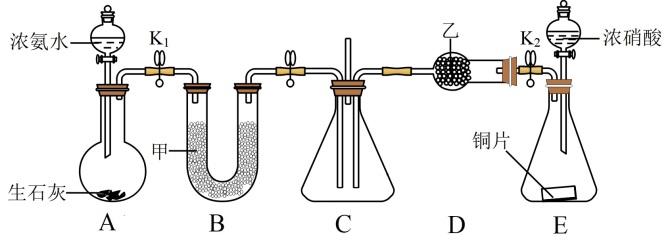
(1)按图示连接好实验装置,检查A装置气密性的方法是_______
(2)U形管中的药品是_______ (填名称)
(3)可用NH3将NO2转化为无毒气体,写出该反应的化学方程式:_______ ,此反应中氧化产物和还原产物的质量之比为_______ 。
(4)此实验装置存在的一个明显缺陷是_______ 。
探究Ⅱ:采用如图装置收集NO2和O2的混合气体,探究NO2、O2混合气体的喷泉实验(装置已略去)。
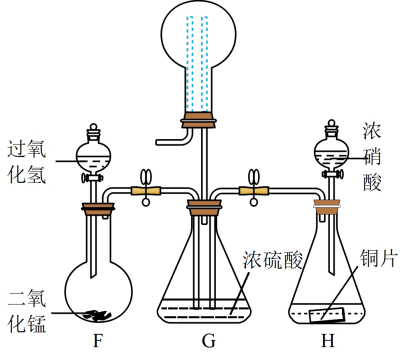
(5)G装置圆底烧瓶中的虚线表示导管,左侧导管_______ (填“长”或“短”,下同),右侧导管_______
(6)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收(Vm≈22.4L/mol),则所得溶液物质的量浓度为_______ mol∙L−1 (保留两位有效数字)
探究I:利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持及固定装置略去)。

(1)按图示连接好实验装置,检查A装置气密性的方法是
(2)U形管中的药品是
(3)可用NH3将NO2转化为无毒气体,写出该反应的化学方程式:
(4)此实验装置存在的一个明显缺陷是
探究Ⅱ:采用如图装置收集NO2和O2的混合气体,探究NO2、O2混合气体的喷泉实验(装置已略去)。

(5)G装置圆底烧瓶中的虚线表示导管,左侧导管
(6)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收(Vm≈22.4L/mol),则所得溶液物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料制取FeCl3。已知FeCl3易升华,易潮解。
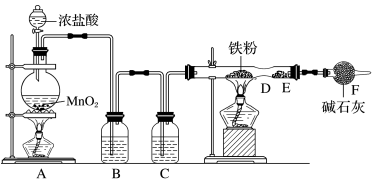
(1)装置B、C中应盛放的试剂名称分别为_______ 、_______ ;从装置A导出的气体若不经过装置B、C而直接进入D管,将对实验产生的不良后果是_______ 。
(2)实验时,先点燃A处的酒精灯,让Cl2充满装置,再点燃D处酒精灯,写出D中反应的化学方程式:_______ 。
(3)装置F所起的作用是_______ 。

(1)装置B、C中应盛放的试剂名称分别为
(2)实验时,先点燃A处的酒精灯,让Cl2充满装置,再点燃D处酒精灯,写出D中反应的化学方程式:
(3)装置F所起的作用是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】在实验室利用胆矾晶体(CuSO4·5H2O)和烧碱溶液制备氧化铜固体,其实验过程可
分为如下几个步骤:①混合;②过滤;③加热分解;④溶解;⑤洗涤。
完成下列填空:
(1)实验正确的操作顺序是:④ →___________→___________→⑤→___________(填序号)。___________
(2)步骤②中所用到的玻璃仪器有___________ 。
(3)在实验过程中多次用到玻璃棒,其作用有___________ 、___________ 。
(4)请分别写出①、③中发生反应的化学方程式并指出反应类型:
①___________ ___________
③___________ ___________
分为如下几个步骤:①混合;②过滤;③加热分解;④溶解;⑤洗涤。
完成下列填空:
(1)实验正确的操作顺序是:④ →___________→___________→⑤→___________(填序号)。
(2)步骤②中所用到的玻璃仪器有
(3)在实验过程中多次用到玻璃棒,其作用有
(4)请分别写出①、③中发生反应的化学方程式并指出反应类型:
①
③
您最近一年使用:0次



