为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为_______(填字母)。
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视_______ 。
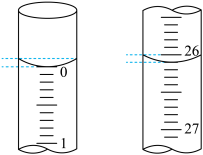
(3)若滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为_______ mL。
(4)某学生根据三次实验分别记录有关数据如下表:
请选用其中合理的数据计算该洗厕精中酸(盐酸)的物质的量浓度:c(HCl)=_______ 。
(5)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:
A.若取待测液时,开始仰视读数,后俯视读数,则_______ (填“偏大”、“偏小”或“无影响”,下同);
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则_______ 。
(1)碱式滴定管的使用方法,正确步骤的先后顺序为_______(填字母)。
| A.用NaOH溶液润洗仪器并加入NaOH溶液 |
| B.放出NaOH溶液进行滴定 |
| C.调节起始读数 |
| D.查漏,再水洗2~3遍 |
(3)若滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为

(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测盐酸的体积/mL | 0.1000mol∙L-1NaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
| 第一次 | 25.00 | 2.00 | 28.15 | 26.15 |
| 第二次 | 25.00 | 1.50 | 29.50 | 28.00 |
| 第三次 | 25.00 | 0.20 | 26.55 | 26.35 |
(5)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:
A.若取待测液时,开始仰视读数,后俯视读数,则
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则
更新时间:2022-09-25 19:29:08
|
【知识点】 酸碱中和滴定的综合考查解读
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室有一瓶未知浓度的Na2S2O3,通过下列实验测定其浓度
①取10.0 mL Na2S2O3于锥形瓶中,滴入指示剂2—3滴。
②取一滴定管,依次查漏,洗涤,用0.01 mol·L-1的I2溶液润洗,然后注入该标准溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是__________ 。
(2)步聚③达到滴定终点的判断__________________________________ 。
(3)已知消耗标准液实验数据如下表:
则废水中的Na2S2O3物质的量浓度为_______________ 。
(4)下列操作会导致测定结果偏高的是_________ 。
A.滴定管在装液前未用标准溶液润洗
B.滴定过程中,锥形瓶振荡得太剧烈,锥形瓶内有液滴溅出
C.装标准溶液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
①取10.0 mL Na2S2O3于锥形瓶中,滴入指示剂2—3滴。
②取一滴定管,依次查漏,洗涤,用0.01 mol·L-1的I2溶液润洗,然后注入该标准溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是
(2)步聚③达到滴定终点的判断
(3)已知消耗标准液实验数据如下表:
| 实验次数 | 始读数(ml) | 末读数(ml) |
| 1 | 0.10 | 19.20 |
| 2 | 1.85 | 20.75 |
| 3 | 0.00 | 24.06 |
则废水中的Na2S2O3物质的量浓度为
(4)下列操作会导致测定结果偏高的是
A.滴定管在装液前未用标准溶液润洗
B.滴定过程中,锥形瓶振荡得太剧烈,锥形瓶内有液滴溅出
C.装标准溶液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】滴定原理在中学化学实验中有着极为重要的应用,现欲采用滴定的方法测定样品中硫酸亚铁的质量分数(约45%),根据反应:
2KMnO4+10FeSO4+8H2SO4 ═ 2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。
步骤如下:
①称量样品3.0 g配成100 mL溶液;
②取20.00 mL待测液,置于锥形瓶中,再加入适量硫酸;
③将0.1 mol/L的标准KMnO4溶液装入滴定管,调节液面至a mL处(见下图);

④滴定待测液至滴定终点时,滴定管液面读数为6;
⑤重复滴定2~3次;
⑥计算。
(1)实验步骤③中的溶液体积读数为________ mL。
(2)实验步骤①、③中还需要使用的最主要的仪器分别为:①________ 、③________ 。
(3)在步骤④的滴定操作中是否需要在待测液中加入指示剂________ 。(填“是”或“否”)
(4)若滴定时每次消耗KMnO4溶液体积的平均值为V mL,则绿矾样品的纯度为________ 。(列出算式即可)如果步骤③中读数时俯视,则最终结果________ 。(填“偏大”、“不变”或“偏小”)
2KMnO4+10FeSO4+8H2SO4 ═ 2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。
步骤如下:
①称量样品3.0 g配成100 mL溶液;
②取20.00 mL待测液,置于锥形瓶中,再加入适量硫酸;
③将0.1 mol/L的标准KMnO4溶液装入滴定管,调节液面至a mL处(见下图);

④滴定待测液至滴定终点时,滴定管液面读数为6;
⑤重复滴定2~3次;
⑥计算。
(1)实验步骤③中的溶液体积读数为
(2)实验步骤①、③中还需要使用的最主要的仪器分别为:①
(3)在步骤④的滴定操作中是否需要在待测液中加入指示剂
(4)若滴定时每次消耗KMnO4溶液体积的平均值为V mL,则绿矾样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】滴定是中学阶段重要的实验之一,请回答下列问题。
用0.1mol·L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

(1)滴定醋酸的曲线是___________ (填“Ⅰ”或“Ⅱ”),可选用的滴定终点指示剂为___________ 。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的是___________ 。
(3)V1和V2的关系:V1___________ V2(填“>”、“=”或“<”)。
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___________ 。
(5)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol-1)可用作定影剂,还原剂。利用K2Cr2O7,标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①称取1.2000g硫代硫酸钠晶体样品配成100mL溶液。
②取0.00950mol·L-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应: 。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:
。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应: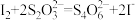 。加入淀粉溶液作为指示剂,继续滴定,当溶液
。加入淀粉溶液作为指示剂,继续滴定,当溶液___________ ,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为___________ 。
用0.1mol·L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

(1)滴定醋酸的曲线是
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的是
(3)V1和V2的关系:V1
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(5)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol-1)可用作定影剂,还原剂。利用K2Cr2O7,标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①称取1.2000g硫代硫酸钠晶体样品配成100mL溶液。
②取0.00950mol·L-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:
 。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:
。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应: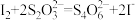 。加入淀粉溶液作为指示剂,继续滴定,当溶液
。加入淀粉溶液作为指示剂,继续滴定,当溶液
您最近一年使用:0次



