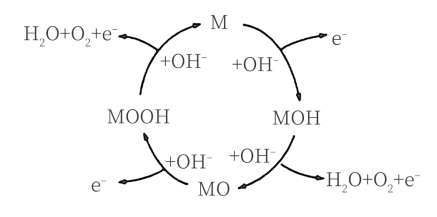
下列说法不正确 的是
| A.能发生有效碰撞的分子属于活化分子 |
| B.催化剂不参加反应,前后质量不变 |
| C.升高温度,活化分子百分数增大 |
| D.活化分子的平均能量与反应物分子的平均能量之差称为活化能 |
更新时间:2022-10-12 14:17:50
|
相似题推荐
【推荐1】下列关于有效碰撞理论的说法不正确的是
| A.发生有效碰撞的分子一定是活化分子 | B.活化分子之间的碰撞一定是有效碰撞 |
C.活化能对反应的 无影响 无影响 | D.降温能降低活化分子的百分数 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】 与环氧丙烷(
与环氧丙烷(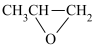 )在催化剂作用下生成
)在催化剂作用下生成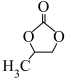 的反应原理如图:
的反应原理如图:
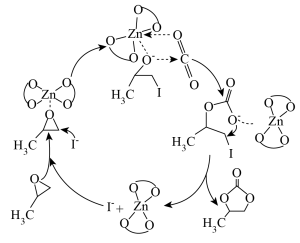
下列有关说法正确的是
 与环氧丙烷(
与环氧丙烷( )在催化剂作用下生成
)在催化剂作用下生成 的反应原理如图:
的反应原理如图:
下列有关说法正确的是
| A.反应过程中C原子的杂化方式没有发生改变 |
| B.反应过程中有极性键和非极性键的断裂 |
| C.催化剂能改变反应历程,改变反应的活化能和反应热,使反应快速达到平衡 |
D.该反应的催化剂为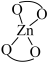 和 和 |
您最近一年使用:0次