高铁酸钾( ,极易溶于水)是常见的水处理剂,其原理如图所示。
,极易溶于水)是常见的水处理剂,其原理如图所示。
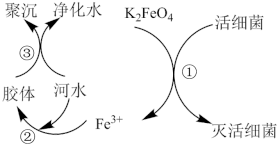
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 价。
(2)过程①中活性菌表现了_______ (填“氧化”或“还原”)性,该过程的还原产物是_______ (填离子符号);过程③属于_______ (填“物理”或“化学”)变化。
(3)根据上述原理分析,作水处理剂时, 的作用有
的作用有_______ 。(填两个)
(4)制备高铁酸钾常用的反应原理为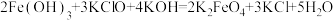 。
。
①通过该反应说明:在碱性条件下,氧化性
_______  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
②将该反应改写为离子方程式:_______ 。
③若该反应中生成2mol ,则电子转移的数目为:
,则电子转移的数目为:_______ 。
 ,极易溶于水)是常见的水处理剂,其原理如图所示。
,极易溶于水)是常见的水处理剂,其原理如图所示。
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)过程①中活性菌表现了
(3)根据上述原理分析,作水处理剂时,
 的作用有
的作用有(4)制备高铁酸钾常用的反应原理为
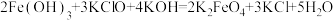 。
。①通过该反应说明:在碱性条件下,氧化性

 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。②将该反应改写为离子方程式:
③若该反应中生成2mol
 ,则电子转移的数目为:
,则电子转移的数目为:
更新时间:2022-11-29 20:44:00
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】如图所示为一“铁链”图案,某化学兴趣小组的同学在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。

(1)将分类依据代号填入相应的横线上:
①两种物质都不是电解质_______ ;
②两种物质都是钠的化合物_______ ;
③两种物质都是氧化物_______ ;
④两种物质都是盐_______ 。
(2)用洁净的烧杯取少量蒸馏水,加热至沸腾,向烧杯中逐滴加入图中某物质的饱和溶液,继续煮沸可制得一种红褐色胶体。
①该物质的化学式为_______ 。
②向该胶体中逐滴加入稀盐酸,会发生一系列变化:
a.先产生红褐色沉淀,原因是_______ 。
b.随后红褐色沉淀溶解,此时发生反应的离子方程式是_______ 。

(1)将分类依据代号填入相应的横线上:
①两种物质都不是电解质
②两种物质都是钠的化合物
③两种物质都是氧化物
④两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,加热至沸腾,向烧杯中逐滴加入图中某物质的饱和溶液,继续煮沸可制得一种红褐色胶体。
①该物质的化学式为
②向该胶体中逐滴加入稀盐酸,会发生一系列变化:
a.先产生红褐色沉淀,原因是
b.随后红褐色沉淀溶解,此时发生反应的离子方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】铁有两种氯化物,都是重要的化工试剂。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
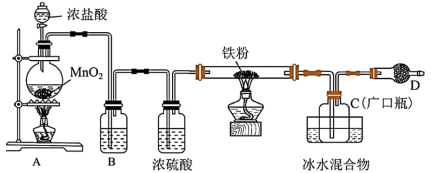
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A装置中盛放浓盐酸的实验仪器名称是_______ 。
(2)A中发生反应的化学方程式为_______ 。
(3)B中试剂的作用是除去氯气中的HCl气体,该试剂是_______ 。
(4)过量铁粉与氯气,加热条件下反应的化学方程式为_______ 。
(5)D中装的药品是碱石灰,其作用是_______ 。
(6)将氯化铁制成氢氧化铁胶体,当光束通过 胶体时,可以看见一条光亮的“通路”,叫做
胶体时,可以看见一条光亮的“通路”,叫做_______ 效应。
(7)该小组在实验中发现稀盐酸与 混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想①:是由于 低所致。
低所致。
猜想②:是由于_______ 所致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入 中,然后通入HCl气体加热
中,然后通入HCl气体加热
b.稀盐酸滴入 中,然后加入NaCl固体加热
中,然后加入NaCl固体加热
c.稀盐酸滴入 中,然后加入浓硫酸加热
中,然后加入浓硫酸加热
d. 与NaCl的浓溶液混合加热
与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、 固体共热
固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想_______ 成立。
(8)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量 溶液;
溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为_______ %(结果精确到小数点后两位)。

查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A装置中盛放浓盐酸的实验仪器名称是
(2)A中发生反应的化学方程式为
(3)B中试剂的作用是除去氯气中的HCl气体,该试剂是
(4)过量铁粉与氯气,加热条件下反应的化学方程式为
(5)D中装的药品是碱石灰,其作用是
(6)将氯化铁制成氢氧化铁胶体,当光束通过
 胶体时,可以看见一条光亮的“通路”,叫做
胶体时,可以看见一条光亮的“通路”,叫做(7)该小组在实验中发现稀盐酸与
 混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:猜想①:是由于
 低所致。
低所致。猜想②:是由于
小组设计了以下实验方案进行验证:
a.稀盐酸滴入
 中,然后通入HCl气体加热
中,然后通入HCl气体加热b.稀盐酸滴入
 中,然后加入NaCl固体加热
中,然后加入NaCl固体加热c.稀盐酸滴入
 中,然后加入浓硫酸加热
中,然后加入浓硫酸加热d.
 与NaCl的浓溶液混合加热
与NaCl的浓溶液混合加热e.浓硫酸与NaCl固体、
 固体共热
固体共热实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想
(8)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量
 溶液;
溶液;③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示
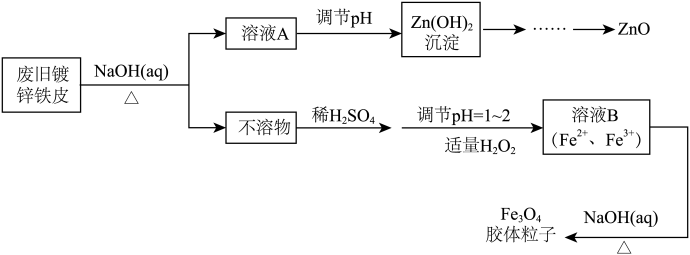
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是_______________________ 。
(2)向不溶物中加入稀硫酸发生反应的离子方程式是____________________________________ 。
(3)加入适量H2O2的目的是__________________________________ 。
(4)如何证明已生成了Fe3O4胶体?_____________________________________________________ 。
(5)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为__________________ mol/L。
(6)稀硫酸也可以用浓硫酸和水配制。已知4 mol/L的硫酸溶液密度为ρ1g/cm3,2 mol/L的硫酸溶液密度为ρ2g/cm3。100g物质的量浓度为4 mol/L的硫酸溶液与___________ mL水混合,使硫酸的物质的量浓度减小到2 mol/L(用含ρ1、ρ2的式子表示)

(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是
(2)向不溶物中加入稀硫酸发生反应的离子方程式是
(3)加入适量H2O2的目的是
(4)如何证明已生成了Fe3O4胶体?
(5)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为
(6)稀硫酸也可以用浓硫酸和水配制。已知4 mol/L的硫酸溶液密度为ρ1g/cm3,2 mol/L的硫酸溶液密度为ρ2g/cm3。100g物质的量浓度为4 mol/L的硫酸溶液与
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
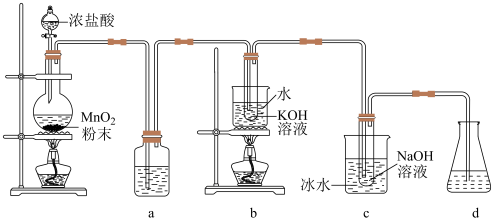
【推荐1】实验室中利用下图装置制备 和
和 ,探究其氧化还原性质。
,探究其氧化还原性质。
已知: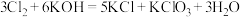
请回答下列问题:
(1)该实验制备氯气的离子方程式为_____ ,盛装浓盐酸的仪器名称为_____ ,a中的试剂为_____ 。检验氯化氢气体中是否混有 ,可采用的方法是
,可采用的方法是_____ 。
A.用加有氢氧化钠的酚酞溶液 B.用干燥有色布条
C.用淀粉碘化钾溶液 D.用饱和食盐水
(2)b中试管内发生反应的氧化剂和还原剂的质量比为________ 。
(3)c中采用冰水浴冷却的目是________ ,c中反应的化学方程式是________ 。
(4)d的作用是吸收多余的氯气,可选用试剂_______。
(5)少量 溶液和
溶液和 溶液分别滴加到1号和2号淀粉-KI试纸上。两个试纸显示的现象不同:1号试纸颜色不变,2号试纸变为
溶液分别滴加到1号和2号淀粉-KI试纸上。两个试纸显示的现象不同:1号试纸颜色不变,2号试纸变为_____ 色。可知该条件下 的氧化能力
的氧化能力_______ (填“大于”或“小于”) 。
。
(6)用制得的氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加 溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法错误的是___________。
溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法错误的是___________。

 和
和 ,探究其氧化还原性质。
,探究其氧化还原性质。
已知:
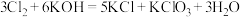
请回答下列问题:
(1)该实验制备氯气的离子方程式为
 ,可采用的方法是
,可采用的方法是A.用加有氢氧化钠的酚酞溶液 B.用干燥有色布条
C.用淀粉碘化钾溶液 D.用饱和食盐水
(2)b中试管内发生反应的氧化剂和还原剂的质量比为
(3)c中采用冰水浴冷却的目是
(4)d的作用是吸收多余的氯气,可选用试剂_______。
| A.稀盐酸 | B. 溶液 溶液 | C.饱和食盐水 | D. 溶液 溶液 |
(5)少量
 溶液和
溶液和 溶液分别滴加到1号和2号淀粉-KI试纸上。两个试纸显示的现象不同:1号试纸颜色不变,2号试纸变为
溶液分别滴加到1号和2号淀粉-KI试纸上。两个试纸显示的现象不同:1号试纸颜色不变,2号试纸变为 的氧化能力
的氧化能力 。
。(6)用制得的氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加
 溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法错误的是___________。
溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法错误的是___________。
| A.阶段①说明氯气溶于水,溶于水的氯气全部与水反应 |
| B.阶段②的压强变小,该过程发生了氧化还原反应 |
C.阶段③发生反应的离子方程式为: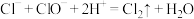 |
D.若将 换成 换成 ,所得的压强变化趋势与图2相似 ,所得的压强变化趋势与图2相似 |
您最近一年使用:0次
【推荐2】矿物资源的利用有着非常重要的意义。工业上由黄铜矿(主要成分 CuFeS2) 冶炼铜的主要流程如下:
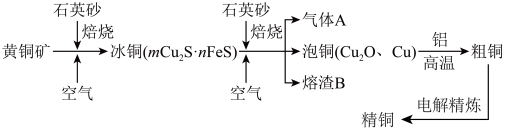
(1)气体 A 中的大气污染物主要成分是__________________ 。
(2)用稀 H2SO4浸泡熔渣 B, 取少量所得溶液,滴加 KSCN溶液后呈红色,说明溶液中存在_____________ (填离子符号),检验溶液中还存在 Fe2+的方案是:_________ 。
(3)工业上用黄铜矿冶炼铜的化学方程式可表示为:8CuFeS2 + 21O2 8Cu+ 4FeO+ 2Fe2O3 +l6SO2 , 其中CuFeS2中Fe的化合价为+2价,反应中被还原的元素是
8Cu+ 4FeO+ 2Fe2O3 +l6SO2 , 其中CuFeS2中Fe的化合价为+2价,反应中被还原的元素是_______________ (填元素符号),每生成 64gCu 转移的电子数为 ____________ (用N A 表示)。
(4)由泡铜冶炼粗铜的化学反应方程式为_______________________ 。

(1)气体 A 中的大气污染物主要成分是
(2)用稀 H2SO4浸泡熔渣 B, 取少量所得溶液,滴加 KSCN溶液后呈红色,说明溶液中存在
(3)工业上用黄铜矿冶炼铜的化学方程式可表示为:8CuFeS2 + 21O2
 8Cu+ 4FeO+ 2Fe2O3 +l6SO2 , 其中CuFeS2中Fe的化合价为+2价,反应中被还原的元素是
8Cu+ 4FeO+ 2Fe2O3 +l6SO2 , 其中CuFeS2中Fe的化合价为+2价,反应中被还原的元素是(4)由泡铜冶炼粗铜的化学反应方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】 是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
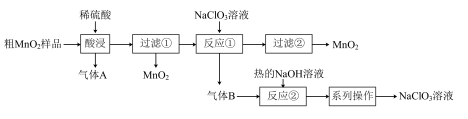
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为___________ 。
(2)反应①的离子方程式为___________ 。
(3)若要得到较浓的 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为___________ (写化学式),“系列操作”为先___________ ,后___________ 。
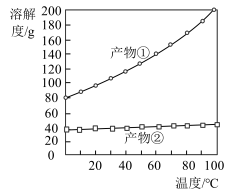
(4)若粗 样品的质量为
样品的质量为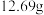 ,经“过滤①”得到
,经“过滤①”得到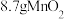 ,并收集到
,并收集到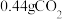 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为___________  。
。
(5)该流程中可循环利用的物质有___________ 。
 是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为
(2)反应①的离子方程式为
(3)若要得到较浓的
 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
(4)若粗
 样品的质量为
样品的质量为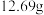 ,经“过滤①”得到
,经“过滤①”得到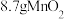 ,并收集到
,并收集到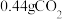 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为 。
。(5)该流程中可循环利用的物质有
您最近一年使用:0次



