I、下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:
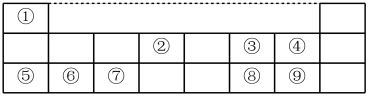
(1)元素⑧在周期表中的位置___________ ;
(2)在①~⑨元素中,某种元素的氧化物可用于呼吸面具中氧气来源,请写出该氧化物与二氧化碳反应的化学方程式___________ 。
(3)等质量的单质⑦分别与足量的稀硫酸和氢氧化钠溶液反应,相同条件下产生的气体体积之比为___________ 。
(4)元素⑨的单质可使湿润的淀粉-KI试纸变蓝,请写出离子方程式___________ 。
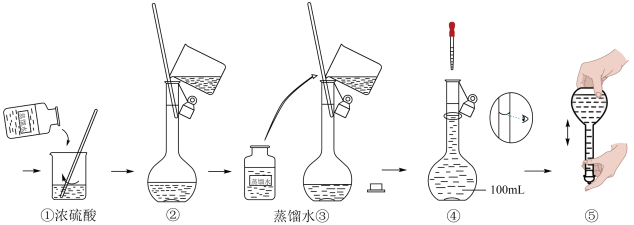
II、如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。

(5)若实验室用该浓硫酸配制240mL0.5mol/L的稀硫酸,请计算需要该浓硫___________ mL(精确到小数点后1位)。
(6)配制过程中的正确操作顺序是:b、d___________ 、e(填“字母”)。
a、用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b、用量筒量取所需体积浓硫酸注入盛有约50mL蒸馏水的烧杯。
c、用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d、用玻璃棒慢慢搅动,混合均匀。
e、盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f、将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g、往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是___________ 。
a、移液过程有H2SO4溶液溅出瓶外
b、移液后未洗涤烧杯和玻璃棒
c、定容时俯视容量瓶刻度线
d、加水超过刻度线,用胶头滴管吸出多余液体
e、洗涤时将量筒洗涤液也加入容量瓶

(1)元素⑧在周期表中的位置
(2)在①~⑨元素中,某种元素的氧化物可用于呼吸面具中氧气来源,请写出该氧化物与二氧化碳反应的化学方程式
(3)等质量的单质⑦分别与足量的稀硫酸和氢氧化钠溶液反应,相同条件下产生的气体体积之比为
(4)元素⑨的单质可使湿润的淀粉-KI试纸变蓝,请写出离子方程式
II、如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。

(5)若实验室用该浓硫酸配制240mL0.5mol/L的稀硫酸,请计算需要该浓硫
(6)配制过程中的正确操作顺序是:b、d
a、用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b、用量筒量取所需体积浓硫酸注入盛有约50mL蒸馏水的烧杯。
c、用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d、用玻璃棒慢慢搅动,混合均匀。
e、盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f、将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g、往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是
a、移液过程有H2SO4溶液溅出瓶外
b、移液后未洗涤烧杯和玻璃棒
c、定容时俯视容量瓶刻度线
d、加水超过刻度线,用胶头滴管吸出多余液体
e、洗涤时将量筒洗涤液也加入容量瓶
更新时间:2023-02-04 09:10:47
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH、Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。回答下列问题
Ⅰ.(1)写出晶片制绒反应的离子方程式__________ ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为_______ 。
Ⅱ.在工业中利用镁制取硅:2Mg+SiO2 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
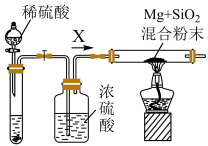
(2)由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________ (填序号)。
a.Na2SO3 b.锌粒 c.纯碱
(3)实验开始时,必须先通入X气体,再加热反应物,其理由是________ ,当反应开始后,移走酒精灯反应能继续进行,其原因是____________ 。
Ⅰ.(1)写出晶片制绒反应的离子方程式
Ⅱ.在工业中利用镁制取硅:2Mg+SiO2
 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
(2)由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用
a.Na2SO3 b.锌粒 c.纯碱
(3)实验开始时,必须先通入X气体,再加热反应物,其理由是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】按要求完成下列电离方程式或离子方程式:
(1)氢氧化钡的电离方程式:_______________________________________________________________ 。
(2)硫酸铝的电离方程式:_________________________________________________________________ 。
(3)硫酸氢钠在水溶液中的电离方程式:_____________________________________________________ 。
(4)氯化铁和氢氧化钾溶液反应的离子方程式:_______________________________________________ 。
(5)氢氧化铜与稀硫酸反应的离子方程式:___________________________________________________ 。
(1)氢氧化钡的电离方程式:
(2)硫酸铝的电离方程式:
(3)硫酸氢钠在水溶液中的电离方程式:
(4)氯化铁和氢氧化钾溶液反应的离子方程式:
(5)氢氧化铜与稀硫酸反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】磷的含氧酸及其盐是一类重要的化工产品,广泛用于食品、肥料、去油去污、防腐蚀、防锈、锅炉水处理等。请回答下列问题:
(1)次磷酸(H3PO2)是一种精细化工产品。向10 mL0.02 mol • L-1H3PO2溶液中加入20 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有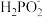 、OH-两种阴离子,则H3PO2是
、OH-两种阴离子,则H3PO2是_______ (填“一元酸”、“二元酸”或“三元酸”)。
(2)已知25℃时K(H3PO2) =1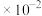 ,该H3PO2溶液的PH为
,该H3PO2溶液的PH为__________ 。
(3)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数K1= 5.0 × 10-2、K2=2.6 ×10-3。
①电离常数K只与温度有关,当温度升高时,K值_____ (填“增大”或“减小”)。
②试从电离平衡移动的角度解释K1、K2数据的差异:____________ 。
(4)25℃时,已知HF的电离常数= 3.6×10-4(H3PO4的电离常数K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。则足量NaF溶液和H3PO4溶液反应的离子方程式为________ 。
(1)次磷酸(H3PO2)是一种精细化工产品。向10 mL0.02 mol • L-1H3PO2溶液中加入20 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有
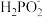 、OH-两种阴离子,则H3PO2是
、OH-两种阴离子,则H3PO2是(2)已知25℃时K(H3PO2) =1
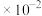 ,该H3PO2溶液的PH为
,该H3PO2溶液的PH为(3)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数K1= 5.0 × 10-2、K2=2.6 ×10-3。
①电离常数K只与温度有关,当温度升高时,K值
②试从电离平衡移动的角度解释K1、K2数据的差异:
(4)25℃时,已知HF的电离常数= 3.6×10-4(H3PO4的电离常数K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。则足量NaF溶液和H3PO4溶液反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】下表是某些短周期元素的电负性值:
(1)通过分析电负性值变化规律,确定 的电负性值范围:
的电负性值范围:_______ 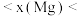
_______ 。
(2)推测 值与原子半径的关系是
值与原子半径的关系是_______ ;根据短周期元素的 值变化特点,体现了元素性质的
值变化特点,体现了元素性质的_______ 变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:
_______ ,
_______ 。
(4)试推断 中化学键类型是
中化学键类型是_______ 。
(5)预测元素周期表中, 值最小的元素位于
值最小的元素位于_______ 周期_______ 族(放射性元素除外)。
| 元素符号 |  |  |  |  |  |  |  |  |  |  |  |  |
电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析电负性值变化规律,确定
 的电负性值范围:
的电负性值范围: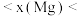
(2)推测
 值与原子半径的关系是
值与原子半径的关系是 值变化特点,体现了元素性质的
值变化特点,体现了元素性质的(3)分别指出下列两种化合物中氧元素的化合价:


(4)试推断
 中化学键类型是
中化学键类型是(5)预测元素周期表中,
 值最小的元素位于
值最小的元素位于
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】元素周期表是学习化学的重要工具。回答下列问题:
(1)硅元素原子核外有______ 种能量不同的电子,有______ 种运动状态不同的电子,写出其最外层电子的电子排布式__________________ 。
(2) 的空间构型和
的空间构型和 相同,写出
相同,写出 的电子式:
的电子式:__________________ 。
(3)部分短周期元素化合价与原子序数的关系可用图示表示。

①元素X在元素周期表中的位置是__________________ 。
②写出元素Y和Z的最高价氧化物对应水化物反应的离子方程式:______________________________ 。
③第三周期主族元素中非金属性最强的两种元素是____________ 和____________ (填元素符号),用一个化学方程式说明这两种元素非金属性的相对强弱:______________________________ 。
(4)第三周期元素的原子所形成的简单离子中:还原性最弱的阴离子是____________ ;氧化性最强的阳离子是____________ 。
(5)写出两种W的含氧酸的化学式____________ 、____________ ,设计一种实验方案比较两种酸的酸性强弱,写出反应的化学方程式:________________________ 。
(1)硅元素原子核外有
(2)
 的空间构型和
的空间构型和 相同,写出
相同,写出 的电子式:
的电子式:(3)部分短周期元素化合价与原子序数的关系可用图示表示。

①元素X在元素周期表中的位置是
②写出元素Y和Z的最高价氧化物对应水化物反应的离子方程式:
③第三周期主族元素中非金属性最强的两种元素是
(4)第三周期元素的原子所形成的简单离子中:还原性最弱的阴离子是
(5)写出两种W的含氧酸的化学式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】下表为元素周期表的一部分,请回答有关问题:
(1)元素⑥的原子结构示意图___________ ;写出⑤的氧化物的一种用途__________ 。
(2)表中⑤和⑥气态氢化物的稳定性顺序为______ >______ (填氢化物的化学式);
(3)表中能形成两性氢氧化物的元素是_________ (填元素符号),该元素的单质与③的氢氧化物水溶液反应的离子反应方程式_______________ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 第2周期 | ① | ② | ||||||
| 第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素⑥的原子结构示意图
(2)表中⑤和⑥气态氢化物的稳定性顺序为
(3)表中能形成两性氢氧化物的元素是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】铁是人体中必需微量元素中含量最多,体内缺失会引起贫血。含FeO 离子的盐具有强氧化性,容易被还原成Fe3+,高铁酸钾是一种新型、高效的消毒剂及绿色净水剂。
离子的盐具有强氧化性,容易被还原成Fe3+,高铁酸钾是一种新型、高效的消毒剂及绿色净水剂。
回答下列有关问题:
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是___________(填字母)。
(2)硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)则下列说法正确的是___________ (选填序号);
(3)工业上常用KClO和KOH的混合液氧化FeCl3来制备K2FeO4
①实验室配制FeCl3溶液时,为了防止FeCl3水解需要将FeCl3溶于浓盐酸中,再加水稀释。现需配制90mL1mol/L的FeCl3溶液,需要用托盘天平称量___________ 克FeCl3•6H2O晶体。配制该溶液所需玻璃仪器有;烧杯,玻璃棒,量筒,___________ ;如果配制时,俯视定容,则所配溶液的浓度___________ (填偏大、偏小或无影响)
②请写出制备高铁酸钾的离子方程式:___________
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中既能杀菌消毒又能混凝净水,请简述原理___________ 。
 离子的盐具有强氧化性,容易被还原成Fe3+,高铁酸钾是一种新型、高效的消毒剂及绿色净水剂。
离子的盐具有强氧化性,容易被还原成Fe3+,高铁酸钾是一种新型、高效的消毒剂及绿色净水剂。 回答下列有关问题:
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是___________(填字母)。
| A.亚硝酸盐被还原 | B.维生素C是还原剂 |
| C.维生素C将Fe3+还原为Fe2+ | D.亚硝酸盐是还原剂 |
| A.从物质分类的角度看,黄铜矿属于合金 |
| B.反应中,铁元素全部被还原 |
| C.反应中,CuFeS2 既作氧化剂又作还原剂 |
| D.当转移1mol电子时,46g CuFeS2参加反应 |
①实验室配制FeCl3溶液时,为了防止FeCl3水解需要将FeCl3溶于浓盐酸中,再加水稀释。现需配制90mL1mol/L的FeCl3溶液,需要用托盘天平称量
②请写出制备高铁酸钾的离子方程式:
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中既能杀菌消毒又能混凝净水,请简述原理
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】实验室欲配制480mL  的
的 溶液,据此回答下列问题:
溶液,据此回答下列问题:
(1)取用任意体积的该 溶液时,下列物理量中不随所取体积的多少而变化的是____________。
溶液时,下列物理量中不随所取体积的多少而变化的是____________。
(2)配制溶液时如用固体 ,应称取
,应称取 质量为
质量为______ g;使用容量瓶之前必须进行的操作是__________ 。
(3)如图所示的实验操作的先后顺序为④⑥②_______________ 。

(4)从配制好的 溶液中取出10mL,将这10mL的
溶液中取出10mL,将这10mL的 溶液稀释至100mL,稀释后
溶液稀释至100mL,稀释后 溶液的浓度变为
溶液的浓度变为______  。
。
(5)下列的实验操作可能导致配制的溶液浓度偏高的是______。
 的
的 溶液,据此回答下列问题:
溶液,据此回答下列问题:(1)取用任意体积的该
 溶液时,下列物理量中不随所取体积的多少而变化的是____________。
溶液时,下列物理量中不随所取体积的多少而变化的是____________。A.溶液中 的物质的量 的物质的量 | B.溶液的物质的量浓度 |
| C.溶液的密度 | D.溶液中 的数目 的数目 |
(2)配制溶液时如用固体
 ,应称取
,应称取 质量为
质量为(3)如图所示的实验操作的先后顺序为④⑥②

(4)从配制好的
 溶液中取出10mL,将这10mL的
溶液中取出10mL,将这10mL的 溶液稀释至100mL,稀释后
溶液稀释至100mL,稀释后 溶液的浓度变为
溶液的浓度变为 。
。(5)下列的实验操作可能导致配制的溶液浓度偏高的是______。
| A.容量瓶内原来有少量的水 |
| B.定容时液面超过刻度线,用胶头滴管吸出 |
C.称量所需 的质量时,物品与砝码的位置放反了(1g以下用游码) 的质量时,物品与砝码的位置放反了(1g以下用游码) |
| D.定容时俯视刻度线 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】如图是硫酸试剂标签上的内容。
(1)该硫酸的物质的量浓度为_____ 。
(2)实验室用该硫酸配制 的稀硫酸,则
的稀硫酸,则
①需要用量筒量取该浓硫酸的体积为_____ mL。
②为完成实验,现有仪器:烧杯、10mL量筒、胶头滴管、玻璃棒,还必需的玻璃仪器有_____ 。
(3)下列操作中,容量瓶所具备的功能有_____。
(4)在下列配制过程示意图中,有错误的是(填写序号)_____ 。
(5)在定容操作时,因不慎加水至凹液面最低处超过了刻度线,该如何处理:_____ 。
(6)下列说法正确的是_____ 。
A.洗涤烧杯和玻璃棒2-3次,并将洗涤液移入容量瓶以减少误差
B.将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
E.容量瓶在使用前未干燥,里面有少量蒸馏水,所配溶液浓度会偏低
硫酸化学纯(CP) (500 mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84 g/cm3 质量分数:98% |
(1)该硫酸的物质的量浓度为
(2)实验室用该硫酸配制
 的稀硫酸,则
的稀硫酸,则①需要用量筒量取该浓硫酸的体积为
②为完成实验,现有仪器:烧杯、10mL量筒、胶头滴管、玻璃棒,还必需的玻璃仪器有
(3)下列操作中,容量瓶所具备的功能有_____。
| A.配制一定体积准确浓度的标准溶液 |
| B.长期贮存溶液 |
| C.用来溶解固体溶质 |
| D.常用来代替烧杯作为反应容器 |
(4)在下列配制过程示意图中,有错误的是(填写序号)

(5)在定容操作时,因不慎加水至凹液面最低处超过了刻度线,该如何处理:
(6)下列说法正确的是
A.洗涤烧杯和玻璃棒2-3次,并将洗涤液移入容量瓶以减少误差
B.将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
E.容量瓶在使用前未干燥,里面有少量蒸馏水,所配溶液浓度会偏低
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】氯及其化合物在生产、生活中都有重要的应用,实验室要配制一定物质的量浓度的稀盐酸。
(1)如图是某市售盐酸试剂瓶标签上的部分数据,则该盐酸的物质的量浓度___________ 
(2)某同学需要240mL1.00mol/L的稀盐酸,用该市售盐酸试剂稀释配制,请回答下列问题:
①通过计算可知,雷要用量筒量取该市售盐酸试剂___________ mL。配制过程需要的仪器有:量筒、烧杯、玻璃棒、胶头滴管、______________ 。
②用该市售盐酸试剂配制1.00mol/L的稀盐酸过程中,其正确的操作顺序是(字母表示,每个字母只能用一次)__________________ 。
A.用胶头滴管加水至溶液凹液面与刻度线相切
B.用量筒准确量取浓盐酸的体积,沿内壁加入盛有少量水(约80mL)的烧杯中,用玻璃棒慢慢搅动
C.将已冷却的盐酸溶液沿玻璃棒注入选定的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
F.用蒸馏水洗涤烧杯和玻璃棒2-3次,并将每次洗涤液都注入容量瓶中
③下列配制过程中导致溶液浓度偏低的是___________ 。
A.定容时俯视刻度线
B.配制前,容量瓶中有少量蒸馏水
C.配制时,盐酸溶液未冷却直接定容
D.定容摇匀后液面低于刻度线,又加蒸馏水至刻度线
E.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
(3)取任意体积该市售盐酸试剂,下列物理量不随所取体积的多少而变化的是___________ 。若取出10mL该市售盐酸试剂加水稀释100倍,稀释前后保持不变的是___________ 。
A.溶液中HCl的物质的量 B.溶液中 的浓度
的浓度
C.溶液中 分子的数目 D.溶液的密度
分子的数目 D.溶液的密度
(1)如图是某市售盐酸试剂瓶标签上的部分数据,则该盐酸的物质的量浓度

| 化学式:HCl 相对分子质量:36.5 密度:1.18g/mL 质量分数:36.5% 符合 GB622-89 |
(2)某同学需要240mL1.00mol/L的稀盐酸,用该市售盐酸试剂稀释配制,请回答下列问题:
①通过计算可知,雷要用量筒量取该市售盐酸试剂
②用该市售盐酸试剂配制1.00mol/L的稀盐酸过程中,其正确的操作顺序是(字母表示,每个字母只能用一次)
A.用胶头滴管加水至溶液凹液面与刻度线相切
B.用量筒准确量取浓盐酸的体积,沿内壁加入盛有少量水(约80mL)的烧杯中,用玻璃棒慢慢搅动
C.将已冷却的盐酸溶液沿玻璃棒注入选定的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
F.用蒸馏水洗涤烧杯和玻璃棒2-3次,并将每次洗涤液都注入容量瓶中
③下列配制过程中导致溶液浓度偏低的是
A.定容时俯视刻度线
B.配制前,容量瓶中有少量蒸馏水
C.配制时,盐酸溶液未冷却直接定容
D.定容摇匀后液面低于刻度线,又加蒸馏水至刻度线
E.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
(3)取任意体积该市售盐酸试剂,下列物理量不随所取体积的多少而变化的是
A.溶液中HCl的物质的量 B.溶液中
 的浓度
的浓度C.溶液中
 分子的数目 D.溶液的密度
分子的数目 D.溶液的密度
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】二氧化氯( ,极易溶于水)消毒泡腾片常用作消毒剂,主要含有亚氯酸钠(
,极易溶于水)消毒泡腾片常用作消毒剂,主要含有亚氯酸钠( )、泡腾剂(
)、泡腾剂( )、固体酸(例如柠檬酸)等成分。当将少量二氧化氯泡腾片投入大量水中时,
)、固体酸(例如柠檬酸)等成分。当将少量二氧化氯泡腾片投入大量水中时, 与酸反应得到亚氯酸(HClO2),亚氯酸分解释放二氧化氯:
与酸反应得到亚氯酸(HClO2),亚氯酸分解释放二氧化氯: ,同时泡腾剂(
,同时泡腾剂( )与酸反应释放
)与酸反应释放 ,加速泡腾片在水中的崩解和溶解,使得泡腾片迅速溶于水,形成低浓度二氧化氯的稀水溶液消毒剂。请回答下列问题:
,加速泡腾片在水中的崩解和溶解,使得泡腾片迅速溶于水,形成低浓度二氧化氯的稀水溶液消毒剂。请回答下列问题:
(1) 中Cl的化合价为
中Cl的化合价为_______ 价, 在水中的电离方程式为
在水中的电离方程式为________ 。
(2)从氧化还原角度分析, 可能具有的性质为
可能具有的性质为________ 。
(3)用上述泡腾片配制 溶液。(已知泡腾片中
溶液。(已知泡腾片中 的质量分数为45.25%)
的质量分数为45.25%)
①需要用托盘天平称取泡腾片的质量为_______ g,亚氯酸分解释放二氧化氯的过程中转移的电子数为_______  。
。
②配制溶液时,除天平(带砝码,最小砝码为1g)、镊子,还缺少的仪器是_______ (填标号)。
③下列操作使配制的 溶液浓度偏低的有
溶液浓度偏低的有________ (填标号)。
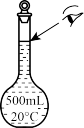
A.称量时,砝码与泡腾片放反了
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.砝码上沾有杂质
E.某同学观察液面的情况如上图所示
(4)已知“有效氯”的含量定义为从KI中氧化出相同量的 所需
所需 的质量与指定化合物的质量之比,常以百分数表示。如纯LiClO的“有效氯”为121%,则
的质量与指定化合物的质量之比,常以百分数表示。如纯LiClO的“有效氯”为121%,则 的“有效氯”为
的“有效氯”为_____ (保留三位有效数字)%。
 ,极易溶于水)消毒泡腾片常用作消毒剂,主要含有亚氯酸钠(
,极易溶于水)消毒泡腾片常用作消毒剂,主要含有亚氯酸钠( )、泡腾剂(
)、泡腾剂( )、固体酸(例如柠檬酸)等成分。当将少量二氧化氯泡腾片投入大量水中时,
)、固体酸(例如柠檬酸)等成分。当将少量二氧化氯泡腾片投入大量水中时, 与酸反应得到亚氯酸(HClO2),亚氯酸分解释放二氧化氯:
与酸反应得到亚氯酸(HClO2),亚氯酸分解释放二氧化氯: ,同时泡腾剂(
,同时泡腾剂( )与酸反应释放
)与酸反应释放 ,加速泡腾片在水中的崩解和溶解,使得泡腾片迅速溶于水,形成低浓度二氧化氯的稀水溶液消毒剂。请回答下列问题:
,加速泡腾片在水中的崩解和溶解,使得泡腾片迅速溶于水,形成低浓度二氧化氯的稀水溶液消毒剂。请回答下列问题:(1)
 中Cl的化合价为
中Cl的化合价为 在水中的电离方程式为
在水中的电离方程式为(2)从氧化还原角度分析,
 可能具有的性质为
可能具有的性质为(3)用上述泡腾片配制
 溶液。(已知泡腾片中
溶液。(已知泡腾片中 的质量分数为45.25%)
的质量分数为45.25%)①需要用托盘天平称取泡腾片的质量为
 。
。②配制溶液时,除天平(带砝码,最小砝码为1g)、镊子,还缺少的仪器是

③下列操作使配制的
 溶液浓度偏低的有
溶液浓度偏低的有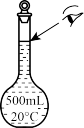
A.称量时,砝码与泡腾片放反了
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.砝码上沾有杂质
E.某同学观察液面的情况如上图所示
(4)已知“有效氯”的含量定义为从KI中氧化出相同量的
 所需
所需 的质量与指定化合物的质量之比,常以百分数表示。如纯LiClO的“有效氯”为121%,则
的质量与指定化合物的质量之比,常以百分数表示。如纯LiClO的“有效氯”为121%,则 的“有效氯”为
的“有效氯”为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】请回答下列问题:
(1)应对新冠肺炎疫情,“84消毒液”是生活中常用的消毒剂。某化学小组配制了500mL“84消毒液”,并在试剂瓶上贴上如图所示标签。
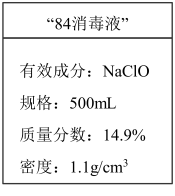
①该“84消毒液”有效成分的物质的量浓度为_______  。
。
②下列说法正确的有_______ 。
A.配制过程只需要四种仪器即可完成
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中的NaClO的物质的量浓度减小
D.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
E.定容时,若加水超过刻度线,应重新配制溶液
F.定容时,若俯视刻度线,会使所配制溶液浓度偏低
③“消毒液”中氯元素的存在形态与溶液pH的关系如表:
请写出pH降低时产生氯气的离子方程式_______ 。
(2)下列各组物质相互混合反应后,最终有白色沉淀生成的是_______ (填序号)。
①金属钠投入到 溶液中
溶液中
② 和足量稀盐酸溶液混合
和足量稀盐酸溶液混合
③少量 投入过量
投入过量 溶液中
溶液中
④氯化钙溶液中通入少量的
⑤向饱和 溶液中通入足量
溶液中通入足量
⑥向 溶液中通入足量
溶液中通入足量 溶液
溶液
(3)汽车剧烈碰撞时安全气囊中发生如下反应: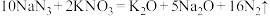 ,若氧化产物比还原产物多19.6g,则反应生成的
,若氧化产物比还原产物多19.6g,则反应生成的 在标况下的体积为
在标况下的体积为_______ L。
(4)某溶液可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:
中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:
Ⅰ.取少量该溶液,加入足量稀硫酸,无明显现象。
Ⅱ.取实验Ⅰ反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生(该气体为 )。
)。
①该溶液中肯定存在的离子有_______ 。
②若取原溶液进行焰色试验,焰色显黄色,则溶液中一定存在的离子有_______ 种。
(1)应对新冠肺炎疫情,“84消毒液”是生活中常用的消毒剂。某化学小组配制了500mL“84消毒液”,并在试剂瓶上贴上如图所示标签。

①该“84消毒液”有效成分的物质的量浓度为
 。
。②下列说法正确的有
A.配制过程只需要四种仪器即可完成
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中的NaClO的物质的量浓度减小
D.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
E.定容时,若加水超过刻度线,应重新配制溶液
F.定容时,若俯视刻度线,会使所配制溶液浓度偏低
③“消毒液”中氯元素的存在形态与溶液pH的关系如表:
| 溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
| 主要成分 | NaClO | HCl与NaClO(少量) | HCl与 (少量) (少量) | HClO与 |  |
(2)下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到
 溶液中
溶液中②
 和足量稀盐酸溶液混合
和足量稀盐酸溶液混合③少量
 投入过量
投入过量 溶液中
溶液中④氯化钙溶液中通入少量的

⑤向饱和
 溶液中通入足量
溶液中通入足量
⑥向
 溶液中通入足量
溶液中通入足量 溶液
溶液(3)汽车剧烈碰撞时安全气囊中发生如下反应:
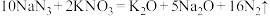 ,若氧化产物比还原产物多19.6g,则反应生成的
,若氧化产物比还原产物多19.6g,则反应生成的 在标况下的体积为
在标况下的体积为(4)某溶液可能含有
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:
中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:Ⅰ.取少量该溶液,加入足量稀硫酸,无明显现象。
Ⅱ.取实验Ⅰ反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生(该气体为
 )。
)。①该溶液中肯定存在的离子有
②若取原溶液进行焰色试验,焰色显黄色,则溶液中一定存在的离子有
您最近一年使用:0次



