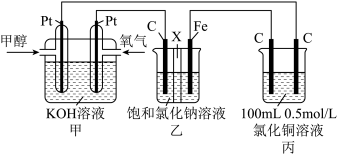
原电池是化学对人类的一项重大贡献。回答下列问题:
(1)铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
①某原电池装置如图所示,右侧烧杯中的电极反应式为___________ 。
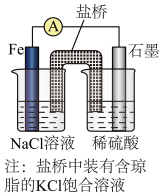
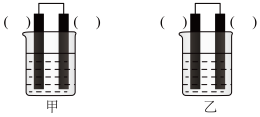
②已知下图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料___________ (填“Fe”或“C”)。
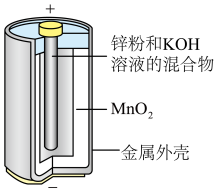
(2)碱性锌锰干电池的剖面图如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH,则其总反应式为___________ ,负极电极反应式为___________ 。
(3)用高铁(Ⅵ)酸盐设计的高铁(Ⅵ)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极电极反应式:___________ 。
②用高铁(Ⅵ)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2 mol K2FeO4反应时,则在电解池中生成___________ L(标准状况) H2。
(1)铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
①某原电池装置如图所示,右侧烧杯中的电极反应式为

②已知下图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料

(2)碱性锌锰干电池的剖面图如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH,则其总反应式为

(3)用高铁(Ⅵ)酸盐设计的高铁(Ⅵ)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极电极反应式:
②用高铁(Ⅵ)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2 mol K2FeO4反应时,则在电解池中生成
更新时间:2023/03/09 18:03:13
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】根据化学能转化为电能的相关知识,回答下列问题:
I.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是____ ,发生____ (填“氧化”或”还原”)反应,电解质溶液是____ 。
(2)正极上出现的现象是____ 。
II.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图:
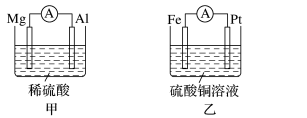
(3)丙装置中负极反应式为____ ,丁装置中负极反应式为____ 。
(4)电池的放电过程中,甲装置中溶液质量____ (填“增加”或“减少”);丁装置中溶液碱性____ (填“增强”或减弱”)。
(5)当甲装置导线中转移0.3mol电子时,正极生成气体____ L(标准状况下);假设开始时乙装置中两电极质量相等,导线中转移0.3mol电子时,两电极质量相差____ g。
I.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是
(2)正极上出现的现象是
II.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图:


(3)丙装置中负极反应式为
(4)电池的放电过程中,甲装置中溶液质量
(5)当甲装置导线中转移0.3mol电子时,正极生成气体
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】原电池揭示了氧化还原反应的本质是电子转移,实现了化学能转化成电能,使氧化还原反应在现代生活中获得重大应用,从而改变了人们的生活方式。某兴趣小组为探究原电池工作原理,利用金属Zn与稀H2SO4反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。
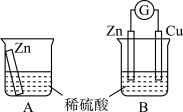
根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作______ (填“正”或“负”)极,Zn电极上的电极反应式为_____ 。
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“电子导体”中电子的流动方向可描述为______ 。
(3)从能量转化的角度来看,装置A中反应物的总能量______ (填“高于”、“低于”或“=”)生成物的总能量;从反应速率的角度上看,可以观察到A中反应比B中______ (填“快”或“慢”)。
(4)该小组同学由此得出的结论错误的是______ 。(多选)

根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“电子导体”中电子的流动方向可描述为
(3)从能量转化的角度来看,装置A中反应物的总能量
(4)该小组同学由此得出的结论错误的是
| A.任何自发进行的氧化还原反应均可以设计成原电池 |
| B.装置B中Cu电极不可用碳棒代替 |
| C.原电池的负极发生还原反应 |
| D.原电池装置中化学能全部转化为电能 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】某化学小组的同学为探究原电池原理,设计如图所示装置,将锌、铜通过导线相连,置于稀硫酸中.

(1)锌片上的电极反应式为_____ .
(2)铜片上的现象是_____ .
(3)若反应过程中有0.2mol电子发生转移,则生成的气体在标准状况下的体积为_____ .
(4)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是_____ (填序号).
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(5)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现.下列反应可以设计成原电池的是_____ (填字母代号).
A. NaOH+HCl═NaCl+H2O B. 2H2+O2═2H2O
C. Fe+2FeCl3═3FeCl2 D. 2H2O═2H2↑+2O2↑

(1)锌片上的电极反应式为
(2)铜片上的现象是
(3)若反应过程中有0.2mol电子发生转移,则生成的气体在标准状况下的体积为
(4)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(5)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现.下列反应可以设计成原电池的是
A. NaOH+HCl═NaCl+H2O B. 2H2+O2═2H2O
C. Fe+2FeCl3═3FeCl2 D. 2H2O═2H2↑+2O2↑
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)反应Zn+CuSO4=ZnSO4+Cu的能量变化趋势如图所示:
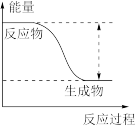
①该反应为___________ 反应(填“吸热”或“放热”)。
②从能量变化的角度看,下列反应与该反应属于同一类型的是___________ 。
A.CaCO3 CO2↑+CaO B.2NaOH+H2SO4=Na2SO4+2H2O
CO2↑+CaO B.2NaOH+H2SO4=Na2SO4+2H2O
C.CO2+C 2CO D.NaHCO3+HCl=NaCl+CO2↑+H2O
2CO D.NaHCO3+HCl=NaCl+CO2↑+H2O
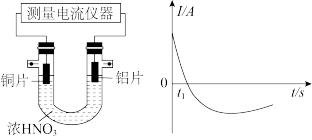
③某化学兴趣小组将Zn+CuSO4=ZnSO4+Cu设计成原电池(如图),该装置中电流的方向是____ (填“Zn→Cu”或“Cu→Zn”),电解质溶液为CuSO4,溶液中SO 移向电极
移向电极____ (填“Zn”或“Cu”),Cu电极的电极反应式为___________ 。若两电极质量相等,当电路中转移0.2mol电子后,两电极的质量差___________ g。
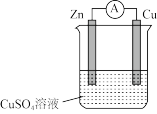
(2)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了如图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中t1时刻之前,Cu电极是______ (填“正极”或“负极”),t1时刻之后,正极反应式为_____ 。根据以上现象,最终得出结论:在原电池中,构成原电池的负极不一定是较活泼的金属材料。
(1)反应Zn+CuSO4=ZnSO4+Cu的能量变化趋势如图所示:

①该反应为
②从能量变化的角度看,下列反应与该反应属于同一类型的是
A.CaCO3
 CO2↑+CaO B.2NaOH+H2SO4=Na2SO4+2H2O
CO2↑+CaO B.2NaOH+H2SO4=Na2SO4+2H2OC.CO2+C
 2CO D.NaHCO3+HCl=NaCl+CO2↑+H2O
2CO D.NaHCO3+HCl=NaCl+CO2↑+H2O③某化学兴趣小组将Zn+CuSO4=ZnSO4+Cu设计成原电池(如图),该装置中电流的方向是
 移向电极
移向电极
(2)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了如图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中t1时刻之前,Cu电极是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
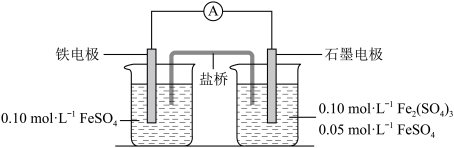
回答下列问题:
(1)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________ 电极溶液中。
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________ 。
(3)根据(1)、(2)实验结果,可知石墨电极的电极反应式为___________________ ,铁电极的电极反应式为_______________________________ 。因此,验证了Fe2+氧化性小于________ 、还原性小于________ 。

回答下列问题:
(1)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=
(3)根据(1)、(2)实验结果,可知石墨电极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时,要通入适量空气使部分甲烷燃烧,其目的是____________ 。已知25℃、101 kPa时,1 mol甲烷完全燃烧生成CO2和液态水时放出896 kJ热量,则甲烷的热值为___ kJ·g-1。
(2)一定温度下,在偏铝酸亚铜(CuAlO2)的催化作用下,CH4与CO2转化成乙酸,可实现“CO2减排”,写出反应的化学方程式__________ ,其优点是_____ (请写出一条)。
(3)甲烷可以消除氮氧化物污染。如: CH4(g)+2NO2(g) N2(g) + CO2(g) + 2H2O(g)。
N2(g) + CO2(g) + 2H2O(g)。
①下列措施能够加快化学反应速率的是______ 。
a. 使用催化剂 b. 降低温度 c. 及时分离水
②若上述反应在恒容密闭容器中进行,则下列叙述能说明该反应达平衡的是_____ 。
a. 混合气体的质量不再变化
b. c(NO2) = 2c(N2)
c. 单位时间内生成1 mol CO2,同时生成2 mol NO2
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
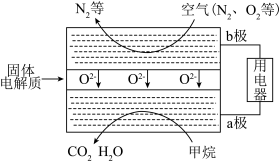
①b极电极反应式为_________ 。
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积分数为20%),则理论上消耗甲烷____ mol。
(1)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时,要通入适量空气使部分甲烷燃烧,其目的是
(2)一定温度下,在偏铝酸亚铜(CuAlO2)的催化作用下,CH4与CO2转化成乙酸,可实现“CO2减排”,写出反应的化学方程式
(3)甲烷可以消除氮氧化物污染。如: CH4(g)+2NO2(g)
 N2(g) + CO2(g) + 2H2O(g)。
N2(g) + CO2(g) + 2H2O(g)。①下列措施能够加快化学反应速率的是
a. 使用催化剂 b. 降低温度 c. 及时分离水
②若上述反应在恒容密闭容器中进行,则下列叙述能说明该反应达平衡的是
a. 混合气体的质量不再变化
b. c(NO2) = 2c(N2)
c. 单位时间内生成1 mol CO2,同时生成2 mol NO2
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:

①b极电极反应式为
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积分数为20%),则理论上消耗甲烷
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)用惰性电极电解CuSO4溶液(如图的装置),
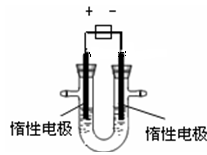
该过程中电解池电极反应式为是阳极:__________ , 阴极:______________ 。
(2)若电解池中装入足量溶液,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为_________ (假设气体全部逸出)。
(3)欲使电解液恢复到起始状态,应向溶液中加入适量的_____
(4)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如下:
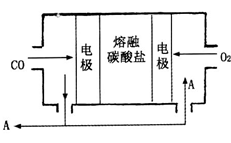
负极电极反应式为_________________________ ,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为__________________ 。

该过程中电解池电极反应式为是阳极:
(2)若电解池中装入足量溶液,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为
(3)欲使电解液恢复到起始状态,应向溶液中加入适量的
| A.CuSO4 | B.H2O | C.CuO | D.CuSO4·5H2O |
(4)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如下:

负极电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】CuSO4溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究。
i. 下图是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。

①该原电池的正极为____ ,其外电路中的电子是从____ 极(填“Zn”或“Cu”)流出。
②电解质溶液乙是______ 溶液,Zn极的电极反应式是_______ 。
③如果盐桥中的成分是K2SO4溶液,则盐桥中向左侧烧杯中移动的离子主要是_____ 。
ii. 下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。
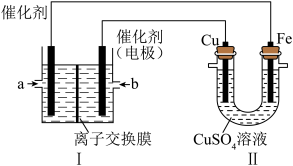
①同学想在Ⅱ中实现铁上镀铜,则Cu作____ 极,电极反应式为______ ,当线路中有0.1mol电子通过时,阴极增重_____ g。Ⅰ中消耗氧气体积是_____ L(标况下)。
②a处通入的是____ (填“CH4”或“O2”),b处电极上发生的电极反应式是___ 。Ⅰ中的总反应方程式为___ 。
③该同学若将Ⅱ中的两个电极都换成铂电极,当线路中有0.1mol电子通过时,测得溶液pH=______ (100mL的CuSO4溶液),则Ⅱ中的总反应方程式为 _______ 。
i. 下图是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。

①该原电池的正极为
②电解质溶液乙是
③如果盐桥中的成分是K2SO4溶液,则盐桥中向左侧烧杯中移动的离子主要是
ii. 下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。

①同学想在Ⅱ中实现铁上镀铜,则Cu作
②a处通入的是
③该同学若将Ⅱ中的两个电极都换成铂电极,当线路中有0.1mol电子通过时,测得溶液pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】人们常常利用化学反应将化学能转化为热能、电能等其他形式的能量,用于生产、生活和科研。请回答下列问题:
(1)已知:
反应I: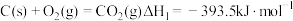
反应II: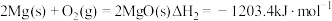
写出 与
与 反应的热化学方程式
反应的热化学方程式___________ 。
(2)为实现低碳环保的目标,北京冬奥会各赛区推广使用氢氧燃料电池汽车。某种氢氧燃料电池的内部结构示意图如下。
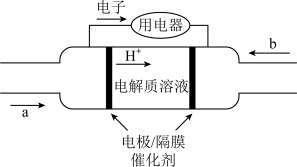
①a处通入的气体是___________ (填化学式),右侧的电极反应式为___________ 。
②若电路中通过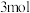 电子,则负极消耗物质的质量为
电子,则负极消耗物质的质量为___________ g。
(3)通过 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
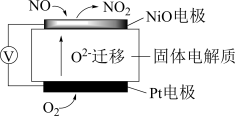
① 电极上发生的是
电极上发生的是___________ 反应。(填“氧化”或“还原”)
②外电路中,电子流动方向是___________ (填字母)。
A.从 电极流向
电极流向 电极 B.从
电极 B.从 电极流向
电极流向 电极
电极
③ 电极上的电极反应式为
电极上的电极反应式为___________ 。
(1)已知:
反应I:
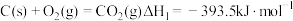
反应II:
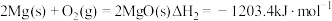
写出
 与
与 反应的热化学方程式
反应的热化学方程式(2)为实现低碳环保的目标,北京冬奥会各赛区推广使用氢氧燃料电池汽车。某种氢氧燃料电池的内部结构示意图如下。

①a处通入的气体是
②若电路中通过
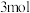 电子,则负极消耗物质的质量为
电子,则负极消耗物质的质量为(3)通过
 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
①
 电极上发生的是
电极上发生的是②外电路中,电子流动方向是
A.从
 电极流向
电极流向 电极 B.从
电极 B.从 电极流向
电极流向 电极
电极③
 电极上的电极反应式为
电极上的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】I.一种利用电化学原理治污的装置如下图,其反应原理是6NO2+8NH3=7N2+12H2O
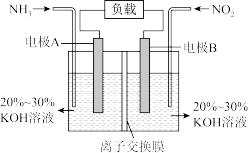
(1)A电极的电极反应式为___________ 。
(2)下列关于该电池说法正确的是___________(填序号)。
II.全钒液流电池(VFB)是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图为VFB放电工作原理。
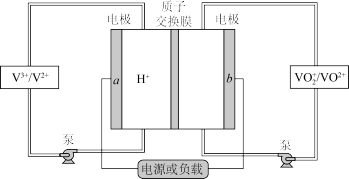
(3)电极b为___________ 极(填“正”或“负”)。充电时,该电极的反应为___________ 。
(4)若负载为如图2所示的装置,A、B、C、D均为石墨电极。
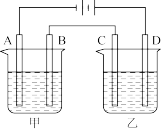
①甲槽是电极电解饱和食盐水的装置,产生40 g NaOH时,VFB电池中消耗___________ mol H+。
②乙槽为200 mLCuSO4溶液,当C电极析出0.64 g物质时,则乙槽中生成的H2SO4的物质的量为___________ mol。
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为___________ (用NA表示)
(5)锂离子电池的一种工作方式为Li+在电池两极的嵌入或迁出,以石墨做正极时,充电过程中,Li+在该石墨电极上___________ (填“嵌入”或“迁出”)。

(1)A电极的电极反应式为
(2)下列关于该电池说法正确的是___________(填序号)。
| A.电子从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
| C.电池工作一段时间,溶液的pH不变 |
| D.当有44.8 LNO2被处理时,转移电子的物质的量为8 mol |
II.全钒液流电池(VFB)是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图为VFB放电工作原理。

(3)电极b为
(4)若负载为如图2所示的装置,A、B、C、D均为石墨电极。

①甲槽是电极电解饱和食盐水的装置,产生40 g NaOH时,VFB电池中消耗
②乙槽为200 mLCuSO4溶液,当C电极析出0.64 g物质时,则乙槽中生成的H2SO4的物质的量为
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
(5)锂离子电池的一种工作方式为Li+在电池两极的嵌入或迁出,以石墨做正极时,充电过程中,Li+在该石墨电极上
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的______ 极。若改用AlCl3水溶液作电解液,则阴极产物为______ 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为___________ mol。
(3)用铝粉和Fe2O3做铝热反应实验,化学方程式为______________________ 需要的试剂还有__________________ 。
a.KCl b. KClO3 c. MnO2 d. Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象_______ (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是________ (用离子方程式说明)。
(1)钢制品应接电源的
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为
(3)用铝粉和Fe2O3做铝热反应实验,化学方程式为
a.KCl b. KClO3 c. MnO2 d. Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象
您最近一年使用:0次