已知 ,若断裂
,若断裂 键、
键、 键、
键、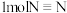 键需要吸收的能量分别为
键需要吸收的能量分别为 、
、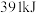 、
、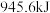 ,则
,则 为
为
 ,若断裂
,若断裂 键、
键、 键、
键、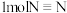 键需要吸收的能量分别为
键需要吸收的能量分别为 、
、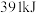 、
、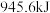 ,则
,则 为
为A. | B.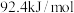 | C.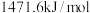 | D. |
2023高三·全国·专题练习 查看更多[2]
更新时间:2023-02-17 18:22:15
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】在 ,
, 与
与 反应时的能量变化如图所示。下列热方程式正确的是
反应时的能量变化如图所示。下列热方程式正确的是
 ,
, 与
与 反应时的能量变化如图所示。下列热方程式正确的是
反应时的能量变化如图所示。下列热方程式正确的是
A.  | B.  |
C.  | D.  |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】我国科研人员研究了不同含金催化剂催化乙烯加氢的反应历程如下图所示(已知反应:C2H4(g)+H2(g)=C2H6(g) △H=akJ·mol-1)
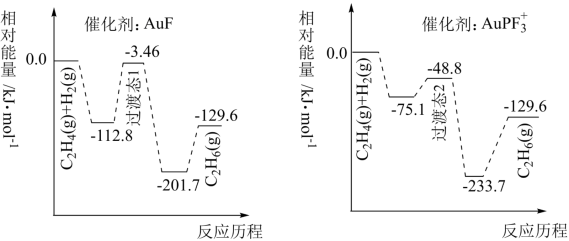
下列说法正确的

下列说法正确的
| A.a=129.6 |
| B.1molC2H4(g)和1molH2(g)的键能之和比lmolC2H6(g)的键能大 |
C.催化乙烯加氢效果较好的催化剂是AuPF |
| D.稳定性:过渡态1>过渡态2 |
您最近一年使用:0次

 和
和 在一定条件下能发生反应:
在一定条件下能发生反应: ,生成2mol
,生成2mol  反应放出热量
反应放出热量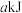 ,已知(
,已知( 、
、 、
、 均大于零),下列说法正确的是
均大于零),下列说法正确的是
 键和1mol
键和1mol  键所需能量大于断开2mol
键所需能量大于断开2mol  键所需能量
键所需能量


