题型:填空题
难度:0.4
引用次数:932
题号:1826046
(一)BaCl2·xH2O中结晶水数目可通过重量法来确定:
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;
(2)计算BaCl2·xH2O中的x= (取整数值)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果 (填“偏低”、“偏高”或“不变”)。
(二)、图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞
如图B所示。且该物质为自然界最硬的物质。

回答下列问题:
(1)图B对应的物质名称是 ,(2)d中元素的原子核外电子排布式为 。
(3)图A中由二种元素组成的物质中,沸点最高的是 ,
(4)图A中的双原子分子中,极性最大的分子是 。
(5)k的分子式为 ,
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;
(2)计算BaCl2·xH2O中的x= (取整数值)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果 (填“偏低”、“偏高”或“不变”)。
(二)、图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞
如图B所示。且该物质为自然界最硬的物质。

回答下列问题:
(1)图B对应的物质名称是 ,(2)d中元素的原子核外电子排布式为 。
(3)图A中由二种元素组成的物质中,沸点最高的是 ,
(4)图A中的双原子分子中,极性最大的分子是 。
(5)k的分子式为 ,
更新时间:2013-12-09 17:24:51
|
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】下图是一种钯(Pd)的氯配合物X的晶胞结构。回答下列问题:
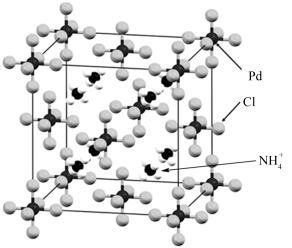
请回答下列问题:
(1)基态Cl原子中存在未成对电子的能级,画出其该能级的轨道表示式______ 。
(2)下列关于Cl元素的叙述正确的是______ (填序号)。
A.Cl2分子中无π键 B.Cl是p区主族元素
C.第一电离能:Cl<S D.电负性:Cl>S
(3)NCl3分子的中心原子N的杂化方式是______ 。
(4) NH3常作制冷剂,其键角______ (填“大于”或“小于”)NH4+的键角,NH3的沸点高于N2沸点的主要原因是______ 。
(5) 物质X的晶体类型为______ ,其中的Pd元素的化合价为______ 、配位数为______ 。
(6) 配合物Y是含有Pd的平面四方的配合物,经过元素分析与计算可知Y中Pd : Cl : N : H的数量比=1:2:2:6。试画出配合物Y的可能结构______ 。

请回答下列问题:
(1)基态Cl原子中存在未成对电子的能级,画出其该能级的轨道表示式
(2)下列关于Cl元素的叙述正确的是
A.Cl2分子中无π键 B.Cl是p区主族元素
C.第一电离能:Cl<S D.电负性:Cl>S
(3)NCl3分子的中心原子N的杂化方式是
(4) NH3常作制冷剂,其键角
(5) 物质X的晶体类型为
(6) 配合物Y是含有Pd的平面四方的配合物,经过元素分析与计算可知Y中Pd : Cl : N : H的数量比=1:2:2:6。试画出配合物Y的可能结构
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐2】(1)请用下列几种物质的序号填空:
①MgCl2 ②Na2S ③NH4NO3 ④K2O2 ⑤Ca(OH)2 ⑥Na2CO3 ⑦SiF4
既有离子键又有非极性键的是________ ;既有离子键又有极性键的是________ 。
(2)X、Y是构成上述物质元素中的两种,能形成XY2型化合物,已知XY2中共有38个电子,若XY2为离子化合物,用电子式表示XY2的形成过程_______ ;若XY2为共价化合物时,其电子式为____________ 。
①MgCl2 ②Na2S ③NH4NO3 ④K2O2 ⑤Ca(OH)2 ⑥Na2CO3 ⑦SiF4
既有离子键又有非极性键的是
(2)X、Y是构成上述物质元素中的两种,能形成XY2型化合物,已知XY2中共有38个电子,若XY2为离子化合物,用电子式表示XY2的形成过程
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐3】X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
(1) X、Y、Z的第一电离能从大到小的顺序是___________(用元素符号表示,下同)。
(2)写出W的价电子排布式_____________,W同周期的元素中,与W原子最外层电子数相等的元素还有____________。
(3)根据等电子体原理,可知化合物XZ的结构式是__________, YZ2-的VSEPR模型是___________。
(4) X、Y、Z的.简单氮化物的键角从大到小的顺序是_______(用化学式表示),原因是________________
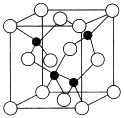
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式___________,该物质硬度大,推测该物质为_________晶体。其中Y元素的杂化方式是______。
(6)U的晶体属立方晶系,其晶胞边长为405pm ,密度是2.70g/cm3,通过计算确定其晶胞的类型_____(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(已知:4053=6.64×107)。
(1) X、Y、Z的第一电离能从大到小的顺序是___________(用元素符号表示,下同)。
(2)写出W的价电子排布式_____________,W同周期的元素中,与W原子最外层电子数相等的元素还有____________。
(3)根据等电子体原理,可知化合物XZ的结构式是__________, YZ2-的VSEPR模型是___________。
(4) X、Y、Z的.简单氮化物的键角从大到小的顺序是_______(用化学式表示),原因是________________
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式___________,该物质硬度大,推测该物质为_________晶体。其中Y元素的杂化方式是______。
(6)U的晶体属立方晶系,其晶胞边长为405pm ,密度是2.70g/cm3,通过计算确定其晶胞的类型_____(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(已知:4053=6.64×107)。

您最近半年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】以下是合成乙酰水杨酸(阿司匹林)的实验流程图,请你回答有关问题:
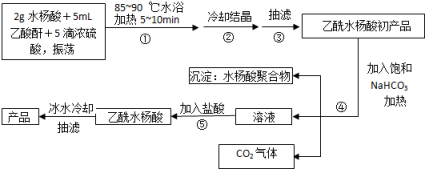
已知:阿司匹林、水杨酸和乙酸酐的相对分子量分别为:180、138、102.
(1)制取阿司匹林的化学反应方程式为_________________ ;反应类型____________ ;
(2)水杨酸分子之间会发生缩合反应生成聚合物,写出用除去聚合物的有关离子方程式______________________________________________ ;
(3)抽滤装置如图所示,仪器A的名称___________ ;该操作时在仪器A中加入滤纸,用蒸馏水湿润后,应________ (选择下列正确操作的编号),再转移液体①微开水龙头;②开大水龙头;③微关水龙头;④关闭水龙头
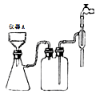
(4)下列有关抽滤的说法中正确的是________
A.抽滤是为了加快过滤速率,得到较大颗粒的晶体
B.不宜用于过滤胶状沉淀或颗粒太小的沉淀
C.当吸滤瓶内液面高度快达到支管口时,应拔掉链接支管口的橡皮管,从支管口倒出
D.将晶体转移至布氏漏斗时,若有晶体附在烧杯内壁,应用蒸馏水淋洗至布氏漏斗中
E.洗涤沉淀时,应使洗涤剂快速通过沉淀
(5)用冷水洗涤晶体的目的_______________________ ;
(6)取2.000g水杨酸、5.400g乙酸酐反应,最终得到产品1.566g。求实际产率_______ ;

已知:阿司匹林、水杨酸和乙酸酐的相对分子量分别为:180、138、102.
(1)制取阿司匹林的化学反应方程式为
(2)水杨酸分子之间会发生缩合反应生成聚合物,写出用除去聚合物的有关离子方程式
(3)抽滤装置如图所示,仪器A的名称

(4)下列有关抽滤的说法中正确的是
A.抽滤是为了加快过滤速率,得到较大颗粒的晶体
B.不宜用于过滤胶状沉淀或颗粒太小的沉淀
C.当吸滤瓶内液面高度快达到支管口时,应拔掉链接支管口的橡皮管,从支管口倒出
D.将晶体转移至布氏漏斗时,若有晶体附在烧杯内壁,应用蒸馏水淋洗至布氏漏斗中
E.洗涤沉淀时,应使洗涤剂快速通过沉淀
(5)用冷水洗涤晶体的目的
(6)取2.000g水杨酸、5.400g乙酸酐反应,最终得到产品1.566g。求实际产率
您最近半年使用:0次
【推荐2】在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
提示:SiO32-+2H+=H2SiO3↓(H2SiO3是白色沉淀)、H2SiO3 SiO2+H2O
SiO2+H2O
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
请回答下列问题。
(1)通过以上实验能确定一定不存在的阳离子是______ ,一定不存在的阴离子是________ 。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_______________ 。
| 阳离子 | K+ Ag+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | NO3- CO32- SiO32- SO42- |
提示:SiO32-+2H+=H2SiO3↓(H2SiO3是白色沉淀)、H2SiO3
 SiO2+H2O
SiO2+H2O现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的阳离子是
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)
| 阴离子 | ① | ② | ||
| c/mol·L-1 |
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐3】实验室常用如图所示装置制取少量乙酸乙酯。请回答下列问题:
(1)试管a中需加入浓硫酸、乙酸各2 mL,乙醇3 mL,应该先加入________ ,再入________ ,最后加入________ 。
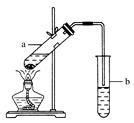
(2)试管a中发生反应的化学方程式是________________ ,反应类型是________ ,通常加入几片碎瓷片,其作用是_______________________________________________________ 。
(3)试管b中加入饱和Na2CO3溶液,其作用是______________________________________ 。
(4)反应结束后,振荡试管b,静置。观察到的现象_________________________________ 。
(1)试管a中需加入浓硫酸、乙酸各2 mL,乙醇3 mL,应该先加入

(2)试管a中发生反应的化学方程式是
(3)试管b中加入饱和Na2CO3溶液,其作用是
(4)反应结束后,振荡试管b,静置。观察到的现象
您最近半年使用:0次



