已知R、W、X、Y、Z是原子序数依次增大的前四周期元素。其中R元素原子的价电子排布为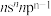 ;非金属元素W的第一电离能小于同周期与其直接相邻的两种元素;X元素原子价电子的未成对电子数与成对电子数相等;Y元素原子中只含两种形状的电子云,最外层只有一种自旋方向的电子;Z元素原子的未成对电子数是该周期最多的。以上涉及的原子均处于基态,下列说法
;非金属元素W的第一电离能小于同周期与其直接相邻的两种元素;X元素原子价电子的未成对电子数与成对电子数相等;Y元素原子中只含两种形状的电子云,最外层只有一种自旋方向的电子;Z元素原子的未成对电子数是该周期最多的。以上涉及的原子均处于基态,下列说法不正确 的是
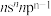 ;非金属元素W的第一电离能小于同周期与其直接相邻的两种元素;X元素原子价电子的未成对电子数与成对电子数相等;Y元素原子中只含两种形状的电子云,最外层只有一种自旋方向的电子;Z元素原子的未成对电子数是该周期最多的。以上涉及的原子均处于基态,下列说法
;非金属元素W的第一电离能小于同周期与其直接相邻的两种元素;X元素原子价电子的未成对电子数与成对电子数相等;Y元素原子中只含两种形状的电子云,最外层只有一种自旋方向的电子;Z元素原子的未成对电子数是该周期最多的。以上涉及的原子均处于基态,下列说法| A.原子半径:Y>X>W>R |
B.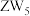 具有强氧化性 具有强氧化性 |
C.R元素的某种单质可以与NaOH溶液反应生成 |
| D.X元素的原子半径较大,原子间不易形成双键 |
更新时间:2023-04-22 15:17:44
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X的最简单氢化物是温室气体之一,Y、W形成的离子化合物可溶于水,Z有“国防金属”之称,W原子的最外层电子数与最内层电子数之和等于其次外层电子数。下列说法正确的是
| A.离子半径:Y<W<Q |
| B.Z单质能置换出X单质 |
| C.Y的离子能促进水的电离 |
| D.简单氢化物的热稳定性:W>Q |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列说法中,正确的是
| A.从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道 |
| B.第一电离能的大小可以作为判断元素金属性强弱的依据 |
| C.原子的电子层数越多,原子半径越大 |
D.硫化氢和水分子结构相似,硫化氢晶体中 的配位数与冰中水分子的配位数相同 的配位数与冰中水分子的配位数相同 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】已知元素X、Y、Z、M和R在周期表中的位置如下图所示,其中X元素基态原子中M能层全充满,N能层只有一个电子。下列关于这5种元素说法正确的是
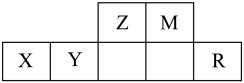
A.第二电离能: | B.M单质常温下不与NaOH溶液反应 |
C.R的核外电子排布式为[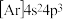 | D.工业上电解Z的氧化物制备Z单质 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】X、Y、Z、M和Q是五种前四周期元素,原子序数依次增大,基态X原子核外电子有3种空间运动状态,基态Z原子的价电子排布式为 ,M与Y同族,基态Q原子有4个未成对电子,下列说法正确的是
,M与Y同族,基态Q原子有4个未成对电子,下列说法正确的是
 ,M与Y同族,基态Q原子有4个未成对电子,下列说法正确的是
,M与Y同族,基态Q原子有4个未成对电子,下列说法正确的是A.Z分别和X、M都能形成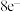 稳定结构的共价晶体 稳定结构的共价晶体 |
B.X、Z形成简单氢化物时,中心原子均为 杂化 杂化 |
| C.同周期元素中,第一电离能介于X和Z之间的元素有2种 |
| D.金属材料中常掺杂Q元素来增强耐磨性和抗腐蚀能力 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。下列说法正确的是( )
| A.Q、R的最高价氧化物对应水化物间可反应 |
| B.Y的简单氢化物比Z的简单氢化物稳定 |
| C.可通过电解熔融氯化物的方法制备Q、R |
| D.X元素单质在化学反应中只表现还原性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】X、Y、Q、Z、W、M、N是原子序数依次增大的前四周期元素,X的核外电子总数与其电子层数相同;Y和W同主族且W的原子序数为基态Y原子价电子数的3倍;Z是同周期中电负性最大的元素,Z与M同主族;基态N原子d轨道中成对电子与单电子的数目比为4:3。说法不正确的是
| A.简单离子半径大小顺序为: W>Y>Q>Z |
| B.W、M形成的一种化合物乙[WM4]+[WM6]-形式存在,其中[WM6]-中心原子杂化方式可能是sp3d2 |
| C.与W同周期且第一电离能介于Mg与W元素之间的元素有2种 |
| D.元素N位于元素周期表的第四周期VIIB族 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】短周期元素X、Y、Z、W、R的化合价与原子序数的关系如下图所示.下列说法不正确 的是( )
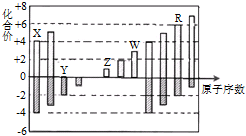

| A.X、Y都存在同素异形现象 |
| B.工业上常用W的氧化物为原料制取单质W |
| C.Z和Y形成的化合物中只存在离子键 |
| D.常温下单质W不能溶于R的最高价氧化物对应水化物的浓溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法错误的是
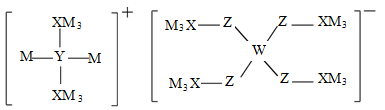
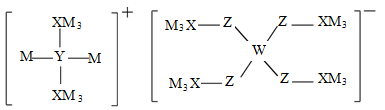
| A.第一电离能:W<X<Y<Z | B.X2M6与YM3·WM3互为等电子体 |
| C.W、X、Y均可形成一元含氧弱酸 | D.阴、阳离子中均有配位键 |
您最近一年使用:0次
【推荐2】五种前四周期的元素X、Y、Z、Q、T。已知X元素基态原子的M层有6种运动状态不同的电子;Y原子的价电子构型为3d84s2,基态Z原子的L层p能级有一个空轨道;Q原子的L电子层的p能级只有一对成对电子;基态T原子的M电子层上p轨道半充满。下列说法错误的是
| A.Y、Q及氢三种元素形成的某化合物,能用于制作可充电电池的电极材料 |
| B.若X、T、Z的最高价的氧化物对应的水化物分别为u、v、w,则酸性为:u>v>w。理由是含氧酸酸性与非羟基氧原子数有关 |
| C.X、Y、T三种元素第一电离能的大小次序是:X>T>Y |
| D.化合物ZQ2、ZX2均是由极性键构成的非极性分子 |
您最近一年使用:0次


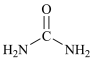 ,下列有关说法正确的是
,下列有关说法正确的是 CO(NH2)2分子中含有7molσ键
CO(NH2)2分子中含有7molσ键

