电池的应用给我们的生活带来了很多便利,请根据原电池工作原理回答下列问题:
(1)现有如下两个反应:①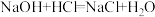 ②
② 。根据两反应本质,判断能设计成原电池的反应是
。根据两反应本质,判断能设计成原电池的反应是_______ (填序号)。该电池的正极材料是_______ 。
(2)锌锰干电池是最早使用的化学电池,其基本构造如图1所示:电路中每通过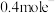 ,负极质量减少
,负极质量减少_______ g;工作时 在正极放电产生两种气体,其中一种气体分子是
在正极放电产生两种气体,其中一种气体分子是 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是_______ 。
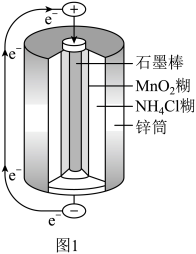
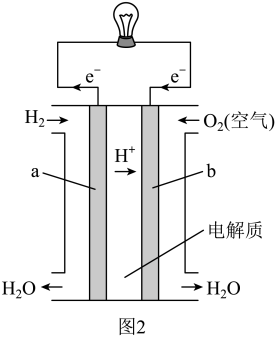
(3)图2为氢氧燃料电池原理示意图。该燃料电池正极的电极反应式_______ 。若导线中通过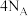 个电子,负极消耗气体的体积为
个电子,负极消耗气体的体积为_______ (标况下)。
(4)直接乙醇燃料电池( )具有很多优点。现有以下三种乙醇燃料电池。
)具有很多优点。现有以下三种乙醇燃料电池。
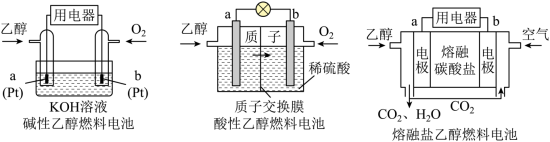
①碱性乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
②酸性乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
③熔融碳酸盐乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
(1)现有如下两个反应:①
 ②
② 。根据两反应本质,判断能设计成原电池的反应是
。根据两反应本质,判断能设计成原电池的反应是(2)锌锰干电池是最早使用的化学电池,其基本构造如图1所示:电路中每通过
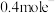 ,负极质量减少
,负极质量减少 在正极放电产生两种气体,其中一种气体分子是
在正极放电产生两种气体,其中一种气体分子是 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是
(3)图2为氢氧燃料电池原理示意图。该燃料电池正极的电极反应式
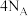 个电子,负极消耗气体的体积为
个电子,负极消耗气体的体积为
(4)直接乙醇燃料电池(
 )具有很多优点。现有以下三种乙醇燃料电池。
)具有很多优点。现有以下三种乙醇燃料电池。
①碱性乙醇燃料电池中,电极a上发生的电极反应式为
②酸性乙醇燃料电池中,电极a上发生的电极反应式为
③熔融碳酸盐乙醇燃料电池中,电极a上发生的电极反应式为
更新时间:2023-04-15 19:05:09
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】合成氨对人类生存具有重大意义:
(1)传统工业合成法:反应为N2(g)+3H2(g) 2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
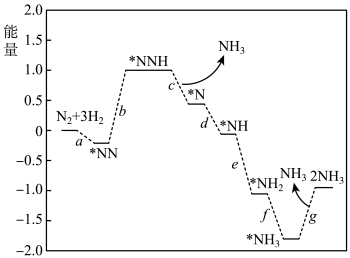
①N2的电子式是___ 。
②写出步骤b的化学方程式___ 。
③由图象可知合成氨反应的∆H__ 0(填“>”、“<”或“=”)。
④工业生产中,除了温度采用400℃—500℃外,促进该反应正向进行的措施是(至少两点)___ 。
(2)电化学制备方法:目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:

①氢化酶区域发生反应的离子方程式是___ 。
②溶液中H+的移动方向是___ (填“向左”或“向右”)。
③下列说法正确的是___ 。
A.该装置可以实现电能转化为化学能
B.电极a是燃料电池的负极
C.该方法相较于传统工业合成方法具有条件温和,对环境友好等优点
(1)传统工业合成法:反应为N2(g)+3H2(g)
 2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
①N2的电子式是
②写出步骤b的化学方程式
③由图象可知合成氨反应的∆H
④工业生产中,除了温度采用400℃—500℃外,促进该反应正向进行的措施是(至少两点)
(2)电化学制备方法:目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:

①氢化酶区域发生反应的离子方程式是
②溶液中H+的移动方向是
③下列说法正确的是
A.该装置可以实现电能转化为化学能
B.电极a是燃料电池的负极
C.该方法相较于传统工业合成方法具有条件温和,对环境友好等优点
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】某化学兴趣小组进行如图所示实验,以检验化学反应中的能量变化。
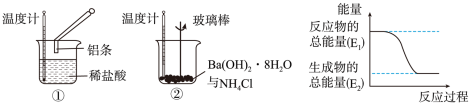
请回答下列问题:
(1)反应①的离子方程式是___________ ;反应②的化学方程式___________ 。
(2)②中的温度___________ (填“升高”或“降低”)。反应___________ (填“①”或“②”)的能量变化可用图表示。
(3)现有如下两个反应:
A.
B.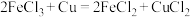
①A反应不能设计成原电池的原因是___________ 。
②利用B反应可设计成原电池,该电池负极的电极反应式为___________ ,可用作该电池正极材料的是___________ (填字母)。
a.碳棒 b.铁片 c.铜片 d.铂棒
(4)用 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
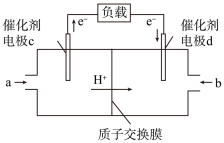
则d电极是燃料电池的___________ (填“正极”或“负极”),此电极的电极反应式为___________ 。

请回答下列问题:
(1)反应①的离子方程式是
(2)②中的温度
(3)现有如下两个反应:
A.

B.
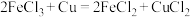
①A反应不能设计成原电池的原因是
②利用B反应可设计成原电池,该电池负极的电极反应式为
a.碳棒 b.铁片 c.铜片 d.铂棒
(4)用
 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
则d电极是燃料电池的
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向,可知氧气从________ 口通入(填“a”或“b”),X极为电池的______ (填“正”或“负”)极。
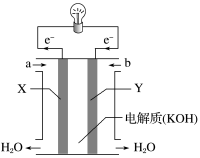
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为
A极:2H2+2O2--4e-=2H2O
B极:O2+4e-=2O2-
则A极是电池的______ 极;电子从该极________ (填“流入”或“流出”)。
(3)微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为:
Zn+2OH--2e-=ZnO+H2O
Ag2O+H2O+2e-=2Ag+2OH-
总反应为Ag2O+Zn=ZnO+2Ag
①Zn是_______ 极,Ag2O发生________ 反应。
②电子由_____ 极流向_____ 极(填“Zn”或“Ag2O”),当电路通过1 mol电子时,负极消耗物质的质量是________ g。
③在使用过程中,电解质溶液中KOH的物质的量_____ (填“增大”“减小”或“不变”)。

(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为
A极:2H2+2O2--4e-=2H2O
B极:O2+4e-=2O2-
则A极是电池的
(3)微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为:
Zn+2OH--2e-=ZnO+H2O
Ag2O+H2O+2e-=2Ag+2OH-
总反应为Ag2O+Zn=ZnO+2Ag
①Zn是
②电子由
③在使用过程中,电解质溶液中KOH的物质的量
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答下列问题:
(1)负极反应为____________________________________ 。
(2)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2 2LiH,Ⅱ.LiH+H2O=LiOH+H2↑,反应Ⅰ中的还原剂是
2LiH,Ⅱ.LiH+H2O=LiOH+H2↑,反应Ⅰ中的还原剂是________ ,反应Ⅱ中的氧化剂是________ 。

(1)负极反应为
(2)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2
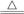 2LiH,Ⅱ.LiH+H2O=LiOH+H2↑,反应Ⅰ中的还原剂是
2LiH,Ⅱ.LiH+H2O=LiOH+H2↑,反应Ⅰ中的还原剂是
您最近一年使用:0次
【推荐2】连二亚硫酸钠(Na2S2O4·2H2O),俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
(1)Na2S2O4中S的化合价为___ 。
(2)生产中常用锌粉与SO2反应制备连二亚硫酸钠。已知锌原子序数为30,位于第四周期,最外层有2个电子,则其次外层电子数为___ 。SO2通入Na2CO3溶液中,有CO2气体生成,这说明___ (填化学式)的酸性比H2CO3的酸性强。
(3)Na2S2O4与水接触能放出大量热的二氧化硫气体和易燃的硫磺蒸气而引起剧烈燃烧。Na2S2O4与水的反应中反应物的总能量___ (填“高于”或“低于”)生成物的总能量。
(4)Li-SO2电池具有高输出功率的优点。其正极为可吸附SO2的多孔碳电极,负极为金属锂,电解液为溶解有LiBr的碳酸丙烯酯一乙腈(一种混合有机溶剂)溶液。电池放电时,正极上发生的电极反应为2SO2+2e-=S2O ,电池总反应式为
,电池总反应式为___ 。该电池不可用水替代混合有机溶剂,其原因是___ 。
(1)Na2S2O4中S的化合价为
(2)生产中常用锌粉与SO2反应制备连二亚硫酸钠。已知锌原子序数为30,位于第四周期,最外层有2个电子,则其次外层电子数为
(3)Na2S2O4与水接触能放出大量热的二氧化硫气体和易燃的硫磺蒸气而引起剧烈燃烧。Na2S2O4与水的反应中反应物的总能量
(4)Li-SO2电池具有高输出功率的优点。其正极为可吸附SO2的多孔碳电极,负极为金属锂,电解液为溶解有LiBr的碳酸丙烯酯一乙腈(一种混合有机溶剂)溶液。电池放电时,正极上发生的电极反应为2SO2+2e-=S2O
 ,电池总反应式为
,电池总反应式为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】氢氧燃料电池是符合绿色化学理念的新型发电装置。其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定。
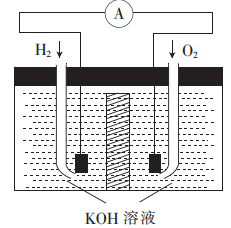
(1)氢氧燃料电池能量转化的主要形式是_______ (填“电能转化为化学能”或“化学能转化为电能”)。
(2)通入H2的电极为______ (填“正极”或“负极”),该电极的电极反应式为____________ 。
(3)电极表面镀铂粉的原因是____________________ 。
(4)随着电池不断放电,电解质溶液的碱性________ (填“增强”“减弱”或“不变”)。

(1)氢氧燃料电池能量转化的主要形式是
(2)通入H2的电极为
(3)电极表面镀铂粉的原因是
(4)随着电池不断放电,电解质溶液的碱性
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,反应过程中忽略溶液体积变化,示意图如下:
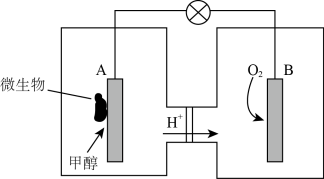
(1)该电池外电路电子的流动方向为______________ 。(填写“从A到B”或“从B到A”)
(2)工作结束后,B电极室溶液的pH与工作前相比将_____________ (填写“增大”、“减小”或“不变”),结合化学用语说明原因______________ 。
(3)A电极附近甲醇发生的电极反应式为______________ 。
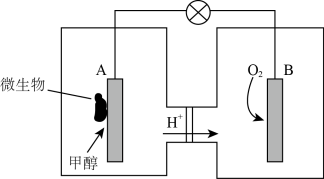
(1)该电池外电路电子的流动方向为
(2)工作结束后,B电极室溶液的pH与工作前相比将
(3)A电极附近甲醇发生的电极反应式为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图:

(1)B极为电池______ 极,B极的电极反应式为______________ 。
(2)该电池工作时,外电路每流过2mol e-,消耗标况下氧气__________ L。

(1)B极为电池
(2)该电池工作时,外电路每流过2mol e-,消耗标况下氧气
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】查阅资料,了解氢氧燃料电池、生物燃料电池等的特点及应用前景_____ 。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】化学电源在生产、生活中有着广泛的应用。回答下列问题:
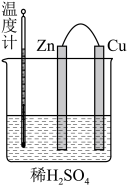
(1)图中,正极电极反应式:______ ;电子流向:______ (填“ ”或“Cu”,下同)极经导线流入
”或“Cu”,下同)极经导线流入______ 极。
(2)铅蓄电池是常见的二次电池,其工作原理如图所示。放电时总反应为 ,负极电极反应式为
,负极电极反应式为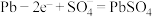 。
。
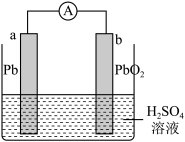
①写出放电时正极的电极反应式:______ ;
②铅蓄电池放电时一段时间,当转移 电子时,负极质量将增大
电子时,负极质量将增大______ g。
(3)金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为 。
。
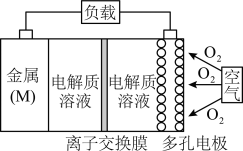
已知:①电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
②阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
比䢂Mg、Al、Zn三种金属-空气电池,则Mg、Al、Zn分别作为电极时“理论比能量”由大到小的顺序为______ ,该电池正极的电极反应式为______ ,若为 -空气电池,为防止负极区沉积
-空气电池,为防止负极区沉积 ,宜采用
,宜采用______ (填“阳离子”或“阴离子”)交换膜。
(1)图中,正极电极反应式:
 ”或“Cu”,下同)极经导线流入
”或“Cu”,下同)极经导线流入
(2)铅蓄电池是常见的二次电池,其工作原理如图所示。放电时总反应为
 ,负极电极反应式为
,负极电极反应式为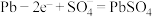 。
。
①写出放电时正极的电极反应式:
②铅蓄电池放电时一段时间,当转移
 电子时,负极质量将增大
电子时,负极质量将增大(3)金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为
 。
。
已知:①电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
②阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
比䢂Mg、Al、Zn三种金属-空气电池,则Mg、Al、Zn分别作为电极时“理论比能量”由大到小的顺序为
 -空气电池,为防止负极区沉积
-空气电池,为防止负极区沉积 ,宜采用
,宜采用
您最近一年使用:0次

 )燃料电池,已知该装置工作时电子从b极流出,a极流入。
)燃料电池,已知该装置工作时电子从b极流出,a极流入。
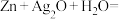
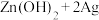 。
。


