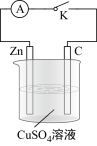
化学电源在生产生活中有着广泛的应用,请回答下列问颕:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是_____ (填字母,下同)。
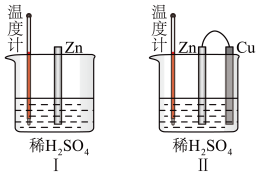
(2)为了探究化学反应中的能量变化,某同学设计了如图两个对比实验(除图Ⅱ中增加导线和铜片外,其余条件完全相同)。经过相同时间后,温度计示数:图I_____ 图Ⅱ(填“高于”、“等于”或“低于”),产生气体的速率:图I_____ 图Ⅱ(填“大于”、“等于”或“小于”)。
(3)理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Fe3+=2Fe2++Cu2+”设计一种化学电池(正极材料用石墨棒),回答下列问题:
①该电池的负极材料是_____ (填化学式),电解质溶液是_____ (填化学式)溶液。
②正极上发生的电极反应为_____ 。
③若导线上转移的电子为1mol,则消耗的金属铜的质量为_____ 。
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是
| A.Ba(OH)2+2NH4Cl=BaCl2+2NH3↑+2H2O | B.Cu+Ag+=Ag+Cu2+ |
| C.Zn+H2SO4=ZnSO4+H2↑ | D.CaO+H2O=Ca(OH)2 |

(3)理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Fe3+=2Fe2++Cu2+”设计一种化学电池(正极材料用石墨棒),回答下列问题:
①该电池的负极材料是
②正极上发生的电极反应为
③若导线上转移的电子为1mol,则消耗的金属铜的质量为
22-23高一下·四川成都·期中 查看更多[2]
更新时间:2023-04-16 20:03:58
|
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】某反应中的反应物和生成物有FeCl3、FeCl2、Cu、CuCl2。有人将上述反应设计成原电池。
(1)则该电池负极材料为:__________________ ,负极反应式为________________ ;
(2)正极材料为:_____________ ,该电池总的化学反应式为_______________ ;
(3)一段时间后负极质量减轻m g,则下列说法正确的是:________ (填写序号)。
A.电路中通过的电子为m/32 mol
B.正极质量增加56m/64 g
C.原电池工作过程中电子由正极经导线流向负极
D.原电池工作过程中Cl−向负极移动
(1)则该电池负极材料为:
(2)正极材料为:
(3)一段时间后负极质量减轻m g,则下列说法正确的是:
A.电路中通过的电子为m/32 mol
B.正极质量增加56m/64 g
C.原电池工作过程中电子由正极经导线流向负极
D.原电池工作过程中Cl−向负极移动
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】(1)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Fe +H2SO4= FeSO4 + H2 ↑;根据两反应本质,判断能否设计成原电池A_______ B_______ (填“能”或“不能”)
(2)根据下图填空

①负极为___________ ,该电极的方程式为__________________
②正极的现象是________________________________ ,发生____________________ 反应(填写“氧化”或“还原”)
③电子从_____ 经导线流向_______ ,溶液中H+向________ 移动(填具体电极材料)。
④若反应过程中有0.1mol电子发生转移,则生成的氢气在标准状况下的体积为______ L。
(2)根据下图填空

①负极为
②正极的现象是
③电子从
④若反应过程中有0.1mol电子发生转移,则生成的氢气在标准状况下的体积为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】铜和铁是常见金属。但生铁易生锈,请讨论电化学实验中有关铁的性质

(1)①已知甲总反应为Fe+2HCl=FeCl2+H2↑,右电极产生H2则甲池中右电极材料为_____ ,左电极材料为_____ 。(填“Fe”或“C”)
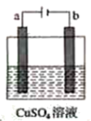
②乙中的电解质为硫酸酸化的CuSO4溶液,现用来电解精炼铜,则左电极材料为_____ 。(填“粗铜”或“纯铜”)
③装置丙中,易生锈的是_____ (填“a”或“b”)点,发生_____ (填“析氢”或“吸氧”)腐蚀,其正极反应式为_____ 。
(2)下图为保护钢闸门的两种方法,根据所学知识完成下列填空:

①利用原电池原理保护钢闸门的是_____ (填“丁”或“戊”),在此过程中_____ (填“Fe”“Zn”或“辅助阳极”)失电子。
②戊装置中通电后,电子流向_____ (填“钢闸门”或“辅助阳极”)

(1)①已知甲总反应为Fe+2HCl=FeCl2+H2↑,右电极产生H2则甲池中右电极材料为
②乙中的电解质为硫酸酸化的CuSO4溶液,现用来电解精炼铜,则左电极材料为
③装置丙中,易生锈的是
(2)下图为保护钢闸门的两种方法,根据所学知识完成下列填空:

①利用原电池原理保护钢闸门的是
②戊装置中通电后,电子流向
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】现有反应:①NaOH+HCl=NaCl+H2O, ②Fe+H2SO4=FeSO4+H2↑。
回答下列问题:
(1)两反应中属于氧化还原反应的是_____ (填序号,下同),能设计成原电池的是___ 。
(2)Fe—Cu原电池的装置如图所示。
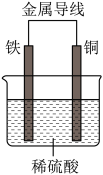
①铁作_____ (填“正极”或“负极”),溶液中H+向____ (填“铁”或“铜”)电极方向移动。
②正极的现象是________ ,负极的电极反应式为________ 。
回答下列问题:
(1)两反应中属于氧化还原反应的是
(2)Fe—Cu原电池的装置如图所示。

①铁作
②正极的现象是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】一定温度下,体积为2L的密闭容器中,X、Y间发生反应。各物质的物质的量随时间变化的关系如图所示。

请回答下列问题:
(1)该反应的化学方程式可表示为_________________ 。在0到1min中内用X表示该反应的速率是________________ ,该反应达最大限度时Y的转化率_______________ 。
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中υ(X)=0.3 mol∙L−1∙min−1,乙中υ(Y)=0.2 mol∙L−1∙min−1,则__________ 中反应更快。
(3)若X、Y均为气体,且X为无色气体,Y为红棕色气体。下列描述能表示反应达平衡状态的是 。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅱ电极上生成氧化物Y(N2O5),则石墨I电极是________ (填“正极”或“负极”),石墨Ⅱ的电极反应式为_______ 。


请回答下列问题:
(1)该反应的化学方程式可表示为
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中υ(X)=0.3 mol∙L−1∙min−1,乙中υ(Y)=0.2 mol∙L−1∙min−1,则
(3)若X、Y均为气体,且X为无色气体,Y为红棕色气体。下列描述能表示反应达平衡状态的是 。
| A.容器中X与Y的物质的量相等 |
| B.容器内气体的颜色不再改变 |
| C.2υ(X)=υ(Y) |
| D.容器内气体的平均相对分子质量不再改变 |

您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】科学家制造出一种使用固体电解质的燃科电池,其效率更高,可用于航天航空。如图是以稀土金属材料作惰性电极,在电极上分别通入氢气和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-。
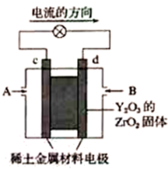
(1)c电极发生___________ 反应(填“氧化”或“还原”),d电极上的电极反应式为___________ 。
(2)下图是用惰性电极电解200 mL 2 mol/L硫酸铜溶液,a电极上的电极反应式:___________ ,若a电极产生112 mL(标准状况)气体, 此时溶液中H+浓度为___________ ( 不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入___________ ( 填字母)。
a、CuO b、CuCO3 c、Cu(OH)2 d、 Cu2(OH)2CO3

(1)c电极发生
(2)下图是用惰性电极电解200 mL 2 mol/L硫酸铜溶液,a电极上的电极反应式:
a、CuO b、CuCO3 c、Cu(OH)2 d、 Cu2(OH)2CO3

您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】化学电池的发明,是贮能和供能技术的巨大进步。
(1)下列可以通过原电池装置实现化学能转化为电能的反应是___________ (填序号)。
①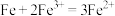 ②
②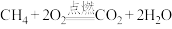 ③NaOH+HCl=NaCl+H2O
③NaOH+HCl=NaCl+H2O
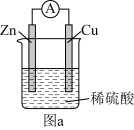
(2)铜锌原电池装置示意图如图a。___________ (填“正极”或“负极”),发生___________ 反应(填“氧化”或“还原”);
②证明化学能转化为电能的实验现象为___________ ;
③该原电池的正极电极反应为___________ ;
④装置中稀硫酸的作用是___________ ;
a.电极材料 b.电极反应物 c.电子导体 d.离子导体
⑤当铜表面生成4.48L氢气(标准状况)时,导线中通过了___________ mol电子。
(3)某锂离子电池的工作原理如图b,电池工作时,电池内部的锂离子定向移动到___________ (填“正极”或“负极”)。
(1)下列可以通过原电池装置实现化学能转化为电能的反应是
①
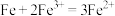 ②
②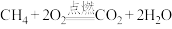 ③NaOH+HCl=NaCl+H2O
③NaOH+HCl=NaCl+H2O(2)铜锌原电池装置示意图如图a。
②证明化学能转化为电能的实验现象为
③该原电池的正极电极反应为
④装置中稀硫酸的作用是
a.电极材料 b.电极反应物 c.电子导体 d.离子导体
⑤当铜表面生成4.48L氢气(标准状况)时,导线中通过了
(3)某锂离子电池的工作原理如图b,电池工作时,电池内部的锂离子定向移动到
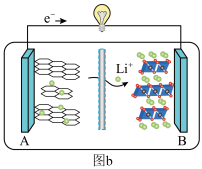
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是_______ (填标号)。
A.C(s)+H2O(g)=CO(g)+H2(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2CO(g)+O2(g)=2CO2(g)
(2)为了探究化学反应中的能量变化,某同学设计了如图所示两个实验。有关实验现象,下列说法正确的是_______(填标号)。

(3)图Ⅱ中外电路中的电子是从_______ (填“Zn”或“Cu”)电极经导线流向_______ 电极。若反应过程中有0.2 mol电子发生转移,则生成的氢气在标准状况下的体积为_______ 。若电池的总反应为2Fe3++Cu=2Fe2++Cu2+,则负极材料是_______ (填化学式)。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是
A.C(s)+H2O(g)=CO(g)+H2(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2CO(g)+O2(g)=2CO2(g)
(2)为了探究化学反应中的能量变化,某同学设计了如图所示两个实验。有关实验现象,下列说法正确的是_______(填标号)。

| A.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面 |
| B.图Ⅱ中产生气体的速率比图Ⅰ快 |
| C.图Ⅰ中温度计的示数高于图Ⅱ的示数 |
| D.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温 |
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】化学电源在日常生活中有着广泛的应用。
(1)将石墨和铜片用导线及电流计相连浸入500mLFeCl3溶液中,构成如图1所示的原电池装置,正极发生的电极反应式为______ ;该电池在工作时,Cu的质量将______ (填“增加”、“减少”或“不变”)。

(2)如图2是甲烷燃料电池的原理示意图:

①电池的正极反应式为______ 。
②电池工作一段时间后,电解质溶液的pH_____ (填“增大”、“减小”或“不变”)。
(3)研究人员发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,电池的总反应方程式为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。
①该电池负极的电极反应式为______ 。
②电池中,Na+不断移动到“水”电池的_______ 极(填“正”或“负”)。
③外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是______ mol。
(1)将石墨和铜片用导线及电流计相连浸入500mLFeCl3溶液中,构成如图1所示的原电池装置,正极发生的电极反应式为

(2)如图2是甲烷燃料电池的原理示意图:

①电池的正极反应式为
②电池工作一段时间后,电解质溶液的pH
(3)研究人员发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,电池的总反应方程式为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。
①该电池负极的电极反应式为
②电池中,Na+不断移动到“水”电池的
③外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是
您最近一年使用:0次