回答下列问题
(1)氨气是一种重要化合物,在工农业生产、生活中有着重要应用。已知:断裂 键需吸
键需吸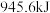 能量,断裂
能量,断裂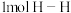 键需吸收
键需吸收 能量,形成
能量,形成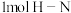 键可放出
键可放出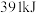 能量。试写出
能量。试写出 的电子式:
的电子式:___________ 。若生成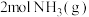 ,热量变化是
,热量变化是___________ (吸收、放出)___________ kJ。
(2)一种用于潜艇的液氨-液氧燃料电池原理示意图如图所示。
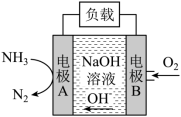
①该燃料电池工作时能量转化关系为___________ 。
②电极B上发生的电极反应式为___________ 。
(3)①已知25℃、 时,
时, 甲烷完全燃烧生成液态水放出
甲烷完全燃烧生成液态水放出 热量,则该条件下1mol
热量,则该条件下1mol 完全燃烧放出的热量为
完全燃烧放出的热量为___________ kJ。
②一种甲烷燃料电池,用强碱做电解质。其负极反应式为___________ ,随着电池不断放电,负极附近溶液的
___________ 。(填“增大”、“减小”或“不变”)。
(1)氨气是一种重要化合物,在工农业生产、生活中有着重要应用。已知:断裂
 键需吸
键需吸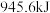 能量,断裂
能量,断裂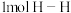 键需吸收
键需吸收 能量,形成
能量,形成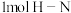 键可放出
键可放出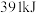 能量。试写出
能量。试写出 的电子式:
的电子式: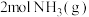 ,热量变化是
,热量变化是(2)一种用于潜艇的液氨-液氧燃料电池原理示意图如图所示。

①该燃料电池工作时能量转化关系为
②电极B上发生的电极反应式为
(3)①已知25℃、
 时,
时, 甲烷完全燃烧生成液态水放出
甲烷完全燃烧生成液态水放出 热量,则该条件下1mol
热量,则该条件下1mol 完全燃烧放出的热量为
完全燃烧放出的热量为②一种甲烷燃料电池,用强碱做电解质。其负极反应式为

更新时间:2023-04-24 09:56:28
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】(1)已知C(s、金刚石)+O2(g)==CO2(g);ΔH= -395.4kJ/mol,C(s、石墨)+O2(g)==CO2(g);ΔH= -393.5kJ/mol。
①石墨和金刚石相比,石墨的稳定性______ 金刚石的稳定性。
②石墨中C-C键键能______ 金刚石中C-C键键能。(均填“大于”、“小于”或“等于”)。
(2)已知H—H键的键能为436 kJ·mol-1,Cl—Cl键的键能为243 kJ·mol-1,H—Cl键的键能为431 kJ·mol-1,则H2(g) +Cl2(g)=2HCl(g)的反应热为______ 。
(3)已知下列反应的反应热:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______________ 。
①石墨和金刚石相比,石墨的稳定性
②石墨中C-C键键能
(2)已知H—H键的键能为436 kJ·mol-1,Cl—Cl键的键能为243 kJ·mol-1,H—Cl键的键能为431 kJ·mol-1,则H2(g) +Cl2(g)=2HCl(g)的反应热为
(3)已知下列反应的反应热:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)已知下列反应:SO2(g)+2OH-(aq)=SO (aq)+H2O(l) ΔH1,ClO-(aq)+SO
(aq)+H2O(l) ΔH1,ClO-(aq)+SO (aq)= SO
(aq)= SO (aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO
(aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO (aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=
(aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=_______ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1则甲醇燃烧生成液态水的热化学方程式:
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1则甲醇燃烧生成液态水的热化学方程式: _______ 。
(3)下表是部分化学键的键能数据,已知1 mol白磷(P4)完全燃烧放热为d kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=_______ kJ·mol-1(用含有a、b、c、d的代数式表示)。

(1)已知下列反应:SO2(g)+2OH-(aq)=SO
 (aq)+H2O(l) ΔH1,ClO-(aq)+SO
(aq)+H2O(l) ΔH1,ClO-(aq)+SO (aq)= SO
(aq)= SO (aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO
(aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO (aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=
(aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1则甲醇燃烧生成液态水的热化学方程式:
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1则甲醇燃烧生成液态水的热化学方程式: (3)下表是部分化学键的键能数据,已知1 mol白磷(P4)完全燃烧放热为d kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=

| 化学键 | P—P | P—O | O=O | P=O |
| 键能/(kJ·mol-1) | a | b | c | x |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】按要求完成下列填空:
(1)在101kPa时,4.0g硫粉在氧气中完全燃烧生成二氧化硫,放出27kJ的热量,硫的燃烧热为_______ 。
(2)在101kPa时,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为_______ 。
(3)天然气中含有的微量H2S会腐蚀管道和设备,在1200℃下进行脱硫处理,H2S会被氧气氧化为SO2,并产生水蒸气。
请写出该反应的热化学方程式:_______ 。
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl(g)和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式_______ 。
(5)已知:H2O(g)=H2O(l) ∆H=-44 kJ/mol;
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ∆H=-1228 kJ/mol。
写出液态酒精完全燃烧后温度恢复到室温时反应的热化学方程式:_______ 。
(1)在101kPa时,4.0g硫粉在氧气中完全燃烧生成二氧化硫,放出27kJ的热量,硫的燃烧热为
(2)在101kPa时,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为
(3)天然气中含有的微量H2S会腐蚀管道和设备,在1200℃下进行脱硫处理,H2S会被氧气氧化为SO2,并产生水蒸气。
| 化学键 | H-S | O=O | H-O | SO2中共价键 |
| 键能/(kJ▪mol-1) | 339 | 498 | 464 | 1083 |
请写出该反应的热化学方程式:
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl(g)和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式
(5)已知:H2O(g)=H2O(l) ∆H=-44 kJ/mol;
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ∆H=-1228 kJ/mol。
写出液态酒精完全燃烧后温度恢复到室温时反应的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)铝—空气燃料电池是一种新型的燃料电池,其工作原理如图所示,其中电解质溶液是KOH溶液,正极反应式为O2+2H2O+4e-=4OH-。试完成下列问题:

①通入空气的电极是___ (填“正”或“负”)极。
②Al电极是___ (填“X”或“Y”)电极。
③电池总反应式为______ (写离子方程式)。
(2)航天技术中使用的氢氧燃料电池具有高能,轻便和无污染等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都为2H2+O2=2H2O。
①酸式氢氧燃料电池的电解质溶液是稀硫酸,其负极反应式为2H2-4e-=4H+,则其正极反应式为______ ;
②碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应式为_____ 。

①通入空气的电极是
②Al电极是
③电池总反应式为
(2)航天技术中使用的氢氧燃料电池具有高能,轻便和无污染等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都为2H2+O2=2H2O。
①酸式氢氧燃料电池的电解质溶液是稀硫酸,其负极反应式为2H2-4e-=4H+,则其正极反应式为
②碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】I.如图所示,某同学设计了一个燃料电池并进行电解实验,请回答下列问题:

(1)甲池中通____ (填“氧气”或“甲烷”)的是负极,其电极反应式为____ 。
(2)标准状况下,若有2.24L氧气参加反应,则乙装置中铁电极上生成气体的物质的量为____ mol。
(3)丙池中铜片上可观察到的现象为____ 。
II.据报道,我国已研制出“可充室温钠-二氧化碳电池”,如图所示,该电池的工作原理为4Na+3CO2 Na2CO3+C(放电时产生的Na2CO3固体贮存于多壁碳纳米管中)。
Na2CO3+C(放电时产生的Na2CO3固体贮存于多壁碳纳米管中)。

(4)放电时,钠箔为该电池的____ 极(填“正”或“负”):电解质溶液中ClO 流向
流向____ (填“钠箔”或“多壁碳纳米管”)电极。
(5)充电时,多糖碳纳米管连接直流电源的____ (填“正”或“负”)极,其电极反应式为____ 。

(1)甲池中通
(2)标准状况下,若有2.24L氧气参加反应,则乙装置中铁电极上生成气体的物质的量为
(3)丙池中铜片上可观察到的现象为
II.据报道,我国已研制出“可充室温钠-二氧化碳电池”,如图所示,该电池的工作原理为4Na+3CO2
 Na2CO3+C(放电时产生的Na2CO3固体贮存于多壁碳纳米管中)。
Na2CO3+C(放电时产生的Na2CO3固体贮存于多壁碳纳米管中)。
(4)放电时,钠箔为该电池的
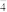 流向
流向(5)充电时,多糖碳纳米管连接直流电源的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题。
(1)补齐物质及其用途的连线。

________________ 。
(2)化学电池的发明,是贮能和供能技术的巨大进步。
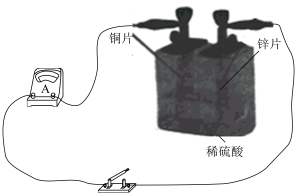
①上图所示装置中, 片作
片作___________ (填“正极”或“负极”), 片上发生反应的电极反应式为
片上发生反应的电极反应式为___________ 。
②上图所示装置可将___________ (写离子反应方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是___________ 。
(3)镁、石墨、海水溶解氧可构成原电池,为水下小功率设备长时间供电,其结构示意图如下图所示。该原电池的总反应为: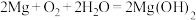 。
。
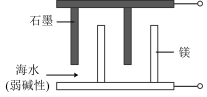
下列说法正确的是___________ (填字母)。
a.石墨是电池的负极
b. 发生氧化反应
发生氧化反应
c.当有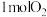 参与反应时转移电子
参与反应时转移电子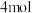
(1)补齐物质及其用途的连线。

(2)化学电池的发明,是贮能和供能技术的巨大进步。

①上图所示装置中,
 片作
片作 片上发生反应的电极反应式为
片上发生反应的电极反应式为②上图所示装置可将
(3)镁、石墨、海水溶解氧可构成原电池,为水下小功率设备长时间供电,其结构示意图如下图所示。该原电池的总反应为:
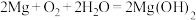 。
。
下列说法正确的是
a.石墨是电池的负极
b.
 发生氧化反应
发生氧化反应c.当有
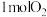 参与反应时转移电子
参与反应时转移电子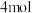
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】某同学为了探究原电池产生电流的过程,设计了如图实验。
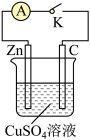
(1)打开K,观察到的现象为________________ 。
(2)关闭K,观察到的现象是_________ 。此电池的负极的电极反应式为_____ 。
(3)关闭K,溶液中阳离子向_______ (填“Zn”或“C”)极移动,外电路中,电子流动方向是________ 。

(1)打开K,观察到的现象为
(2)关闭K,观察到的现象是
(3)关闭K,溶液中阳离子向
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】汽车让人们的生活越来越便捷。请回答以下问题:
(1)汽车尾气主要含有CO2、CO、SO2、NO等物质,是造成城市空气污染的主要因素之一,N2和O2反应生成NO的能量变化如图所示,则由该反应生成1mol NO时,应___________ (填“释放”或“吸收”)___________ kJ能量。
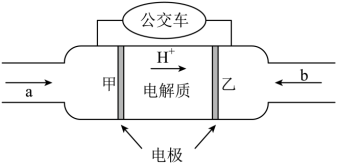
(3)近年来广州首批15辆氢燃料电池公交车已经投入运营,标志着广州公交进入氢能产业时代,如图是某种氢氧燃料电池的内部结构示意图,该电池工作时,氢气从___________ (填“a”或“b”)处通入,正极反应方程式为___________ ,标况下消耗11.2L空气,整个电路中转移的电子数约为___________ NA。___________ ,负极电极反应式为___________ 。
(1)汽车尾气主要含有CO2、CO、SO2、NO等物质,是造成城市空气污染的主要因素之一,N2和O2反应生成NO的能量变化如图所示,则由该反应生成1mol NO时,应




| A.NaN3属于离子化合物 |
| B.NaN3的分解反应属于吸热反应 |
| C.E1表示2mol NaN3固体的能量 |
| D.NaN3作为安全气囊的气体发生剂,具有产气快、产气量大等优点 |
(3)近年来广州首批15辆氢燃料电池公交车已经投入运营,标志着广州公交进入氢能产业时代,如图是某种氢氧燃料电池的内部结构示意图,该电池工作时,氢气从
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】如图为原电池装置示意图:

(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,做负极的分别是___________ 。
a.铝片 铜片 b.铜片 铝片 c.铝片 铝片 d.铜片 铜片
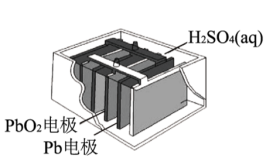
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出B电极反应式:___________ ;该电池工作时,A电极的质量将___________ (填“增加”、“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___________ 。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入CH4和O2,该电池为甲烷燃料电池,该电池工作一段时间后,溶液的碱性将___________ (填“增强”、“减弱”或“不变”)。

(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,做负极的分别是
a.铝片 铜片 b.铜片 铝片 c.铝片 铝片 d.铜片 铜片
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出B电极反应式:
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入CH4和O2,该电池为甲烷燃料电池,该电池工作一段时间后,溶液的碱性将
您最近一年使用:0次



