甲醇是重要的化工原料,工业上由CO、 和
和 合成甲醇的主要反应如下:
合成甲醇的主要反应如下:
I.

II.

III.

已知:反应Ⅲ中相关化学键的数据如下表
则 键的键能a为
键的键能a为
 和
和 合成甲醇的主要反应如下:
合成甲醇的主要反应如下:I.


II.


III.


已知:反应Ⅲ中相关化学键的数据如下表
| 化学键 |  |  |  |  |  |
键能/ | 436 | 343 | a | 465 | 413 |
 键的键能a为
键的键能a为| A.1076 | B.826 | C.779 | D.538 |
更新时间:2023-05-12 17:51:04
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】氢卤酸的能量关系如图所示,下列说法不正确的是


A. 中共价键断裂的过程不一定属于化学变化 中共价键断裂的过程不一定属于化学变化 |
B. |
| C.卤素气态氢化物的稳定性可以通过a的大小来比较 |
D.断裂 中的化学键需要吸收 中的化学键需要吸收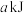 的能量 的能量 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g)+I2(?) 2HI(g) △H1=-9.48kJ•mol-1
2HI(g) △H1=-9.48kJ•mol-1
②H2(g)+I2(?) 2HI(g) △H2=+26.48kJ•mol-1
2HI(g) △H2=+26.48kJ•mol-1
下列判断正确的是
①H2(g)+I2(?)
 2HI(g) △H1=-9.48kJ•mol-1
2HI(g) △H1=-9.48kJ•mol-1②H2(g)+I2(?)
 2HI(g) △H2=+26.48kJ•mol-1
2HI(g) △H2=+26.48kJ•mol-1下列判断正确的是
| A.①中的I2为固态,②中的I2为气态 | B.1mol固态碘升华时将吸热17kJ |
| C.①的产物比②的产物热稳定性更好 | D.②中反应物总键能比生成物总键能大 |
您最近一年使用:0次



