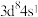解释下列现象的原因不正确的是
| 选项 | 现象 | 原因 |
| A |  中含有共价键 中含有共价键 | Al与Cl元素间的电负性差值小于1.7 |
| B | 碘在 中的溶解度比在水中大 中的溶解度比在水中大 | 碘和 均为非极性分子,水是极性分子 均为非极性分子,水是极性分子 |
| C | 对羟基苯甲醛的熔沸点比邻羟基苯甲醛的高 | 对羟基苯甲醛形成分子间氢键,而邻羟基苯甲醛形成分子内氢键 |
| D | HF的稳定性强于HCl | HF分子之间除了范德华力以外还存在氢键 |
| A.A | B.B | C.C | D.D |
22-23高二下·黑龙江哈尔滨·期中 查看更多[2]
更新时间:2023-05-15 15:50:00
|
相似题推荐
单选题
|
较易
(0.85)
解题方法
【推荐1】已知X、Y元素同周期,且电负性 ,下列说法中错误的是
,下列说法中错误的是
 ,下列说法中错误的是
,下列说法中错误的是| A.第一电离能Y可能大于X |
| B.非金属性:X大于Y |
| C.X和Y形成化合物时,X显负价,Y显正价 |
D.气态氢化物的稳定性: 强于 强于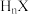 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】现有四种元素的基态原子的核外电子排布式如下:①1s22s22p3;②1s22s22p4;③1s22s22p63s23p2;④1s22s22p63s23p3。下列说法错误的是
| A.电负性:②>①>④>③ |
| B.原子半径:③>④>①>② |
| C.第一电离能:②>①>④>③ |
| D.简单气态氢化物的稳定性:②>①>④>③ |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】下列各组分子中,都由极性键构成的极性分子的一组是
| A.H2O和NH3 | B.CCl4和H2S | C.C2H2和CO2 | D.H2O2和CS2 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】 是常用的氧化剂,其分子结构如下图所示,两个氢原子犹如在半展开的书的页面上。下列关于
是常用的氧化剂,其分子结构如下图所示,两个氢原子犹如在半展开的书的页面上。下列关于 的说法正确的是
的说法正确的是

 是常用的氧化剂,其分子结构如下图所示,两个氢原子犹如在半展开的书的页面上。下列关于
是常用的氧化剂,其分子结构如下图所示,两个氢原子犹如在半展开的书的页面上。下列关于 的说法正确的是
的说法正确的是
A. 是非极性分子 是非极性分子 |
B. 分子中含有σ键、π键、氢键 分子中含有σ键、π键、氢键 |
C. 在 在 中的溶解度小于在 中的溶解度小于在 中的溶解度 中的溶解度 |
D. 的电子式: 的电子式: |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】有关晶体的下列说法中正确的是
| A.晶体中分子间作用力越大,分子越稳定 | B.氯化钠熔化时离子键未被破坏 |
| C.冰熔化时水分子中共价键发生断裂 | D.原子晶体中共价键越强,熔点越高 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】下列事实不能用键能的大小来解释的是
| A.N元素的电负性较大,但N2的化学性质很稳定 |
| B.HCl、HBr、HI的熔沸点逐渐升高 |
| C.HF、HCl、HBr、HI的稳定性逐渐减弱 |
| D.F2比O2更容易与H2反应 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】NA为阿伏加德罗常数的值,下列叙述正确的是
| A.12 g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| B.15.6 g苯中所含碳碳双键数为0.6NA |
| C.18 g冰中含有氢键数为4NA |
| D.标准状况下,22.4 L己烷中共价键数目为19NA |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】新冠疫情以来,过氧乙酸作为一种绿色生态杀菌剂,在抗疫过程中被广泛使用,其结构简式为 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是A.分子中采用 杂化的原子数为1 杂化的原子数为1 |
| B.其熔点主要取决于所含化学键的键能 |
| C.过氧乙酸中含有极性键和非极性键 |
| D.常温下,过氧乙酸难溶于水 |
您最近一年使用:0次

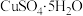 的结构示意图如图。下列说法正确的是
的结构示意图如图。下列说法正确的是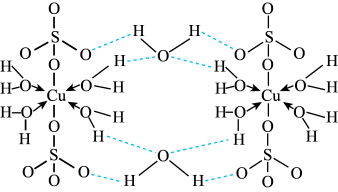
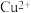 的配位数为5
的配位数为5