下列对于物质结构和性质的分析不正确 的是
| A.碳的原子半径小于硅,使金刚石熔点高于晶体硅 |
| B.邻羟基苯甲醛形成了分子内氢键,其沸点高于对羟基苯甲醛 |
| C.氟的电负性大于氯,导致三氟乙酸的酸性强于三氯乙酸 |
D.卤代烃中 键极性较强,使卤素原子易被取代 键极性较强,使卤素原子易被取代 |
22-23高二下·北京朝阳·期末 查看更多[6]
北京朝阳区2022-2023学年高二下学期期末考试化学试题北京市第十五中学2023-2024学年高三上学期开学考试化学试题北京师范大学良乡附中2023-2024学年高三上学期10月月考化学试题北京师范大学附属实验中学2023-2024学年高二下学期期中考试化学试题(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)(已下线)专题05 结构化学(选择题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)
更新时间:2023-07-12 09:35:00
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列对有关事实的解释错误的是
| 选项事实 | 解释 | |
| A | 酸性:CF3COOH>CH3COOH | F电负性更大使羟基极性变强 |
| B | 金刚石的熔点高于单晶硅 | 金刚石的C-C比单晶硅的Si-Si键能大 |
| C | 稳定性:H2O>H2S | H-O键的键能比H-S键的键能大 |
| D | SiO2的熔点比干冰高 | SiO2比CO2相对分子质量大,分子间作用力大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列各组元素性质的递变情况错误的是
| A.Li、Be、B原子的最外层电子数依次增多 |
| B.P、S、Cl元素的最高化合价依次升高 |
| C.N、O、F电负性依次增大 |
| D.Na、K、Rb第一电离能逐渐增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
真题
名校
【推荐1】中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是
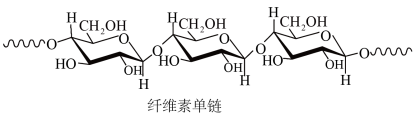
| A.纤维素是自然界分布广泛的一种多糖 |
| B.纤维素难溶于水的主要原因是其链间有多个氢键 |
C.NaOH提供 破坏纤维素链之间的氢键 破坏纤维素链之间的氢键 |
| D.低温降低了纤维素在NaOH溶液中的溶解性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】溴化亚铁(FeBr2)是一种常用的催化剂,易潮解变质,800 ℃以上可升华,高温时溴化铁(FeBr3)迅速分解成溴化亚铁。如图所示制备溴化亚铁(部分夹持仪器未画出),下列说法错误的是


| A.若用浓硫酸代替浓磷酸,则对产品的纯度无影响 |
| B.常温下浓硫酸与浓磷酸黏度较大主要是由于分子间有氢键 |
| C.浓磷酸在与溴化钠反应中体现了磷酸的酸性比氢溴酸的酸性强 |
| D.碱石灰不能用无水氯化钙代替 |
您最近一年使用:0次