氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素,这两种元素位于相邻的周期。
(1)砷有多种同位素原子,其中稳定的核素是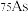 ,它的中子数为
,它的中子数为_______ 。
(2)已知 与
与 的性质相似,则对
的性质相似,则对 性质的推测不正确的是
性质的推测不正确的是_______ 。
A. 含有离子键和共价键 B. 能与 溶液反应
溶液反应
C. 与 受热分解产物的种类完全一样 D. 能与溴水反应
受热分解产物的种类完全一样 D. 能与溴水反应
(3)下列关于第ⅤA族元素及其化合物的说法不正确的是_______ 。
A. 砷单质的氧化性强于磷单质 B. 酸性: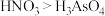
C. 热稳定性: D. 元素原子半径随着原子序数的递增而增大
D. 元素原子半径随着原子序数的递增而增大
(1)砷有多种同位素原子,其中稳定的核素是
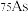 ,它的中子数为
,它的中子数为(2)已知
 与
与 的性质相似,则对
的性质相似,则对 性质的推测不正确的是
性质的推测不正确的是A. 含有离子键和共价键 B. 能与
 溶液反应
溶液反应C. 与
 受热分解产物的种类完全一样 D. 能与溴水反应
受热分解产物的种类完全一样 D. 能与溴水反应(3)下列关于第ⅤA族元素及其化合物的说法不正确的是
A. 砷单质的氧化性强于磷单质 B. 酸性:
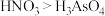
C. 热稳定性:
 D. 元素原子半径随着原子序数的递增而增大
D. 元素原子半径随着原子序数的递增而增大
更新时间:2023-06-10 20:59:14
|
【知识点】 同主族元素性质递变规律
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
(1)ⅰ中反应的离子方程式是__________________________________________ 。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__________________________________ 。
(3)①甲同学认为:实验Ⅱ观察到__________________ 现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
补做实验Ⅲ的目的是___________________________________________________ 。
(4)综合实验Ⅰ和Ⅲ,得出Cl2、Br2、I2氧化性由强到弱的顺序为_____________ 。
(5)实验室的氯水都是实验前新制备,其制备的方法是将氯气通往蒸馏水中使其充分溶解而得到。实验室可用如图装置来制备氯水,下列对于该实验说法正确的是___________ 。

A.甲装置中所用药品为浓盐酸和二氧化锰
B.若在装置乙、丙之间增加一个如图(a)所示装置,制备的氯水更纯净
C.为提高氯水的制备效率,可在丙装置中的长玻璃管下端接一个如图(b)所示的多孔球
D.为了充分吸收尾气并防止倒吸,丁装置可选用如图(c)所示装置
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 实验Ⅰ |  |
| 实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是
(3)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
| 实验Ⅲ | 另取ⅰ中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是
(4)综合实验Ⅰ和Ⅲ,得出Cl2、Br2、I2氧化性由强到弱的顺序为
(5)实验室的氯水都是实验前新制备,其制备的方法是将氯气通往蒸馏水中使其充分溶解而得到。实验室可用如图装置来制备氯水,下列对于该实验说法正确的是

A.甲装置中所用药品为浓盐酸和二氧化锰
B.若在装置乙、丙之间增加一个如图(a)所示装置,制备的氯水更纯净
C.为提高氯水的制备效率,可在丙装置中的长玻璃管下端接一个如图(b)所示的多孔球
D.为了充分吸收尾气并防止倒吸,丁装置可选用如图(c)所示装置
您最近一年使用:0次
【推荐2】依据下列信息,完成填空:
(1)某单质位于短周期,是一种常见的半导体材料。在25℃、101kPa下,其气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是___ 。
(2)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1,2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1,则反应: Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为___ 。
(3)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
①已知t2>t1,生成HX的反应是___ 反应(填“吸热”或“放热”)。
②K的变化体现出X2化学性质的递变性,用原子结构解释原因:___ ,原子半径逐渐增大,得电子能力逐渐减弱。
③在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应达平衡时热量变化值为Q1;反之,2molHI分解达平衡时热量变化值为Q2,则:Q1___ Q2(填“>”“<”“=”)。
(1)某单质位于短周期,是一种常见的半导体材料。在25℃、101kPa下,其气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是
(2)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1,2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1,则反应: Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
(3)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2⇌2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2⇌2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2⇌2HBr | 5.6×107 | 9.3×106 |
| I2+H2⇌2HI | 43 | 34 |
①已知t2>t1,生成HX的反应是
②K的变化体现出X2化学性质的递变性,用原子结构解释原因:
③在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应达平衡时热量变化值为Q1;反之,2molHI分解达平衡时热量变化值为Q2,则:Q1
您最近一年使用:0次




