请阅读下列资料,获取重要信息点,回答下列问题。
信息I:“物质的量”是一个物理量,表示含有一定数目粒子的集体,符号为n,单位为摩尔 。
。
国际上规定,1mol微粒A所含有的该粒子A的数量为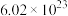 个。例如,
个。例如, 中含有
中含有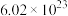 个H2O,含有
个H2O,含有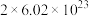 个H。
个H。
信息II:1mol物质B所具有的总质量称为物质B的摩尔质量,符号为M,单位为g/mol。经研究,物质B的摩尔质量在数值上等于物质B的相对原子质量或相对分子质量。 ,即
,即 的质量为44g。
的质量为44g。
信息III:经过大量数据分析,在同温同压下。气体C的体积和气体C的分子数成正比。在0℃和105Pa气压下,1mol任何气体的体积都近似等于22.4L。
信息IV:溶质D的物质的量的浓度,也称摩尔浓度,符号为c,单位是mol/L。可如下描述,在1L水溶液中,所包含溶质D的物质的量,就叫作溶质D的摩尔浓度。
(1)电解完全2mol的水可以得到氧气________ g。
(2)小明查阅资料得知,金属E的密度为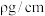 ,金属E晶体为立方体形,在棱长为
,金属E晶体为立方体形,在棱长为 的晶体空间内有E原子b个,则金属E的相对原子质量为
的晶体空间内有E原子b个,则金属E的相对原子质量为________ 。
信息I:“物质的量”是一个物理量,表示含有一定数目粒子的集体,符号为n,单位为摩尔
 。
。国际上规定,1mol微粒A所含有的该粒子A的数量为
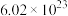 个。例如,
个。例如, 中含有
中含有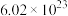 个H2O,含有
个H2O,含有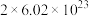 个H。
个H。信息II:1mol物质B所具有的总质量称为物质B的摩尔质量,符号为M,单位为g/mol。经研究,物质B的摩尔质量在数值上等于物质B的相对原子质量或相对分子质量。
 ,即
,即 的质量为44g。
的质量为44g。信息III:经过大量数据分析,在同温同压下。气体C的体积和气体C的分子数成正比。在0℃和105Pa气压下,1mol任何气体的体积都近似等于22.4L。
信息IV:溶质D的物质的量的浓度,也称摩尔浓度,符号为c,单位是mol/L。可如下描述,在1L水溶液中,所包含溶质D的物质的量,就叫作溶质D的摩尔浓度。
(1)电解完全2mol的水可以得到氧气
(2)小明查阅资料得知,金属E的密度为
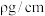 ,金属E晶体为立方体形,在棱长为
,金属E晶体为立方体形,在棱长为 的晶体空间内有E原子b个,则金属E的相对原子质量为
的晶体空间内有E原子b个,则金属E的相对原子质量为
更新时间:2023/06/24 10:44:59
|
相似题推荐
【推荐1】将0.1mol镁和铝的混合物溶于100mL2mol·L-1硫酸中,然后滴加1mol·L-1NaOH溶液。回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。

①有关反应的离子方程式为____ 。
②当V1=160时,金属粉末中n(Mg)=____ mol,V2=___ 。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为___ 。
(3)若混合物仍为0.1mol,其中镁粉的物质的量分数为a,用100mL2mol·L-1硫酸溶解此混合物后,再加入450mL1mol·L-1NaOH溶液,所得沉淀中无Al(OH)3,写出满足此条件的a的取值范围:____ 。
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。

①有关反应的离子方程式为
②当V1=160时,金属粉末中n(Mg)=
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为
(3)若混合物仍为0.1mol,其中镁粉的物质的量分数为a,用100mL2mol·L-1硫酸溶解此混合物后,再加入450mL1mol·L-1NaOH溶液,所得沉淀中无Al(OH)3,写出满足此条件的a的取值范围:
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】将250mLH2SO4的质量分数为98%,密度为1.84g/cm3的浓硫酸稀释到1000mL。
(1)此时溶液中H2SO4的物质的量是多少?
(2)此时溶液中H+的物质的量浓度是多少?
(1)此时溶液中H2SO4的物质的量是多少?
(2)此时溶液中H+的物质的量浓度是多少?
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】填空。
(1)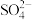 的摩尔质量为
的摩尔质量为_______ ;96g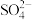 中含有
中含有_______ 个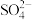 ,所含电子的物质的量为
,所含电子的物质的量为_______ 。
(2)0.5mol 加入适量水中配成2L溶液,则溶质的物质的量浓度是
加入适量水中配成2L溶液,则溶质的物质的量浓度是_______ 。
(3)标况下44.8LHCl气体与_______ g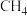 中所含氢原子总数相等。
中所含氢原子总数相等。
(1)
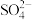 的摩尔质量为
的摩尔质量为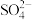 中含有
中含有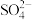 ,所含电子的物质的量为
,所含电子的物质的量为(2)0.5mol
 加入适量水中配成2L溶液,则溶质的物质的量浓度是
加入适量水中配成2L溶液,则溶质的物质的量浓度是(3)标况下44.8LHCl气体与
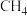 中所含氢原子总数相等。
中所含氢原子总数相等。
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】计算
(1)在标准状况下,10.2gH2S 与标况下_______ LNH3含有相同的H原子。
(2)实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,称取4.420g样品溶于水,配成500mL溶液。取出50.00mL该溶液,加入0. 1000 mol/L Ba(OH)2溶液至50.00mL时沉淀量达到最大。请计算:
①25°C时,0.1000 mol/L Ba(OH)2溶液中的氢氧根离子浓度是_______ mol/L。
②样品中n(NaHCO3):n(Na2CO3)=_______ 。
(1)在标准状况下,10.2gH2S 与标况下
(2)实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,称取4.420g样品溶于水,配成500mL溶液。取出50.00mL该溶液,加入0. 1000 mol/L Ba(OH)2溶液至50.00mL时沉淀量达到最大。请计算:
①25°C时,0.1000 mol/L Ba(OH)2溶液中的氢氧根离子浓度是
②样品中n(NaHCO3):n(Na2CO3)=
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前设法进行综合利用。某硫酸厂每天排放的1万米3(已换算成标准状况)尾气中含0.2%(体积百分数)的SO2。
(1)若用生石灰及氧气处理后,假设硫元素不损失,理论上可得到_______ 千克生石膏?
(2)若用氨水处理,最少需要标况下的氨气_______ 升?最多需要标准状况下的氨气_____ 升?
(1)若用生石灰及氧气处理后,假设硫元素不损失,理论上可得到
(2)若用氨水处理,最少需要标况下的氨气
您最近一年使用:0次

 一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为
一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为 的
的 溶液,生成的沉淀跟加入的
溶液,生成的沉淀跟加入的 ,纵坐标质量单位是g)求:
,纵坐标质量单位是g)求: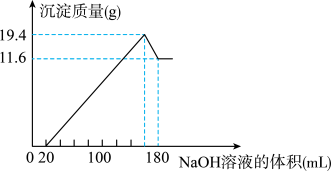
 ,
, 的质量
的质量 的物质的量浓度
的物质的量浓度

