海洋是巨大的资源宝库,可以制取多种物质。
I.海水提溴
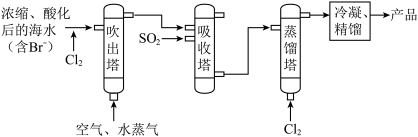
(1)吹出塔中采用气-液逆流的方式(液体从塔顶喷淋,气体从塔底进入),其目的是_______ 。
(2)请写出吸收塔中反应的离子方程式___________ 。
II.海带提碘(海带中碘元素以I-形式存在)
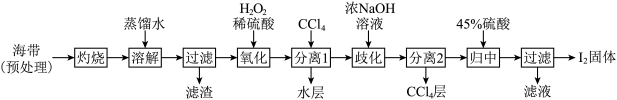
(3)“氧化”过程涉及到的离子方程式是_________ ,请设计一种检验所得溶液含I2的方法:___________ 。
(4)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为________ ;向分离得到的含I-和 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为________ 。
(5)图1是制取碘单质的原电池装置,图2是利用碘研制的新型的锌-碘溴液流电池(图中贮液器可储存电解质溶液,增加电池容量)。
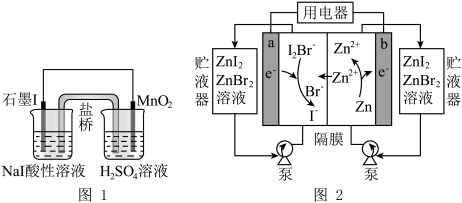
图1中,MnO2极发生的电极反应式为_______ ;图2中,放电时,a电极反应式为________ ,b电极质量减少6.5g时,a电极室增加________ mol离子(不考虑电极室与贮液器的溶液交换)。
I.海水提溴

(1)吹出塔中采用气-液逆流的方式(液体从塔顶喷淋,气体从塔底进入),其目的是
(2)请写出吸收塔中反应的离子方程式
II.海带提碘(海带中碘元素以I-形式存在)

(3)“氧化”过程涉及到的离子方程式是
(4)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为
 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为(5)图1是制取碘单质的原电池装置,图2是利用碘研制的新型的锌-碘溴液流电池(图中贮液器可储存电解质溶液,增加电池容量)。

图1中,MnO2极发生的电极反应式为
更新时间:2023-07-06 14:04:35
|
相似题推荐
【推荐1】地球的表面积为5.1亿平方公里,其中海洋的面积为3.67亿平方公里,占整个地球表面积的70.8%。海洋是一个巨大的化学资源宝库,如图是海水资源综合利用的部分流程图,请根据该图回答下列问题:
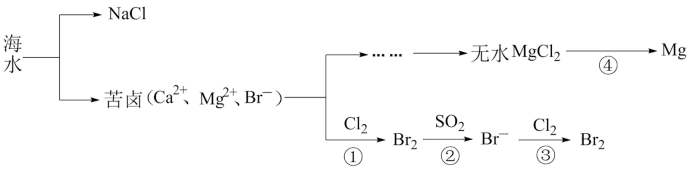
(1)淡化海水的方法有________ (写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、________ (填化学式),之后________ (填操作名称),再加入适量________ (填试剂名称)。
(2)Mg(OH)2中加入盐酸后,要获得MgCl2晶体,需要进行的实验操作依次为:________ 、________ 、过滤、洗涤、干燥。由MgCl2·6H2O脱去结晶水得到无水MgCl2,反应④由无水MgCl2制取金属镁的常用工业方法是________ 。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,目的是________ 。写出反应②的离子方程式________ 。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2。写出反应的化学方程式:________ 。

(1)淡化海水的方法有
 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、(2)Mg(OH)2中加入盐酸后,要获得MgCl2晶体,需要进行的实验操作依次为:
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,目的是
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2。写出反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图(见下页):
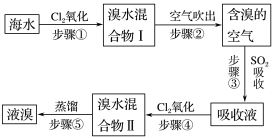
(1)步骤①反应的离子方程式是___ 。
(2)步骤③反应的化学方程式是___ ,从理论上考虑,下列也能吸收Br2的是___ 。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80℃~90℃。温度过高或过低都不利于生产,请解释原因:___ 。

(1)步骤①反应的离子方程式是
(2)步骤③反应的化学方程式是
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80℃~90℃。温度过高或过低都不利于生产,请解释原因:
您最近一年使用:0次
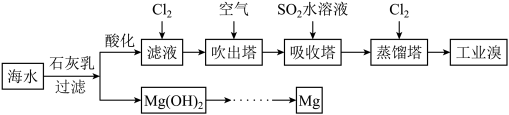
【推荐3】浩瀚的海洋里蕴藏着丰富的化学资源,利用海水可以提取溴和镁,提取过程如下:
①写出“吸收”步骤中反应的化学方程式:___________ ,经过2次Br-→Br2,转化的目的是___________ 。
②“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:___________ 。
(2)在实验中,欲利用获得的Mg(OH)2制取纯净的MgC12·6H2O晶体,请补充实验方案:取一定量Mg(OH)2固体置于烧杯中,___________ ,得到MgC12·6H2O晶体。(可选用试剂:1 mol-L-1 H2SO4溶液、2moL-1HCl溶液、冰水)。
(3)溴量法测定废水中苯酚(C6H6O)含量的过程如下(废水中不含干扰测定的物质)。
步骤1 向盛有5.00mL0.0002mol/L KBrO3溶液的锥形瓶中加入过量KBr,加H2SO4酸化一段时间;
步骤2 加入50.00mL废水,充分反应( );
);
步骤3 向锥形瓶中加入过量KI,生成的I2恰好和4.80mL0.001mol/LNa2S2O3反应( )。
)。
计算该废水中苯酚的含量___________ (单位为mg/L,写出计算过程)。
①写出“吸收”步骤中反应的化学方程式:
②“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:

(2)在实验中,欲利用获得的Mg(OH)2制取纯净的MgC12·6H2O晶体,请补充实验方案:取一定量Mg(OH)2固体置于烧杯中,
(3)溴量法测定废水中苯酚(C6H6O)含量的过程如下(废水中不含干扰测定的物质)。
步骤1 向盛有5.00mL0.0002mol/L KBrO3溶液的锥形瓶中加入过量KBr,加H2SO4酸化一段时间;
步骤2 加入50.00mL废水,充分反应(
 );
);步骤3 向锥形瓶中加入过量KI,生成的I2恰好和4.80mL0.001mol/LNa2S2O3反应(
 )。
)。计算该废水中苯酚的含量
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】海水的综合利用是当今的热点话题之一。
Ⅰ.利用海水可以解决煤燃烧过程中排放的 造成的环境问题。其工艺流程如图所示:
造成的环境问题。其工艺流程如图所示: 吸收含硫的烟气后,会溶有
吸收含硫的烟气后,会溶有 、
、 等分子或离子,需要用氧气进行氧化处理,写出
等分子或离子,需要用氧气进行氧化处理,写出 参加反应的离子方程式
参加反应的离子方程式___________ 。
(2)氧化后的海水需用大量天然海水与之混合后才能排放。该操作的主要目的是___________ 。
Ⅱ.从海水中提取粗盐后的母液中含有 、
、 和
和 等阳离子。对母液进行一系列的加工可制得金属镁。
等阳离子。对母液进行一系列的加工可制得金属镁。
(3)从离子反应的角度思考,在母液中加入石灰乳的作用是___________ 。
(4)电解熔融无水氯化镁所得镁蒸气在特定环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是___________(填字母)。
Ⅲ.海带中含有碘元素。从海带中提取碘的实验过程如下图:___________ 。步骤③的分离操作为___________ 。
(6)写出步骤④反应的离子方程式___________ 。
Ⅰ.利用海水可以解决煤燃烧过程中排放的
 造成的环境问题。其工艺流程如图所示:
造成的环境问题。其工艺流程如图所示: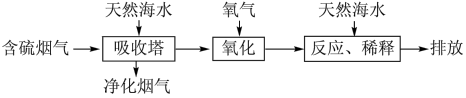
 吸收含硫的烟气后,会溶有
吸收含硫的烟气后,会溶有 、
、 等分子或离子,需要用氧气进行氧化处理,写出
等分子或离子,需要用氧气进行氧化处理,写出 参加反应的离子方程式
参加反应的离子方程式(2)氧化后的海水需用大量天然海水与之混合后才能排放。该操作的主要目的是
Ⅱ.从海水中提取粗盐后的母液中含有
 、
、 和
和 等阳离子。对母液进行一系列的加工可制得金属镁。
等阳离子。对母液进行一系列的加工可制得金属镁。(3)从离子反应的角度思考,在母液中加入石灰乳的作用是
(4)电解熔融无水氯化镁所得镁蒸气在特定环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是___________(填字母)。
A. | B. | C.Ar | D.水蒸气 |
Ⅲ.海带中含有碘元素。从海带中提取碘的实验过程如下图:

(6)写出步骤④反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】物质分离、提纯的常用装置如图所示,根据题意选择合适的装置填入相应位置。

(1)我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”所用的是__ 装置(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)《本草衍义》中对精制砒霜过程的叙述为:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下重如乳,尖长者为胜,平短者次之。”文中涉及的操作方法所用是_____ 装置。
(3)海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:

其中分离步骤①、②、③所用分别为:_____ 装置、_____ 装置、_____ 装置。

(1)我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”所用的是
(2)《本草衍义》中对精制砒霜过程的叙述为:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下重如乳,尖长者为胜,平短者次之。”文中涉及的操作方法所用是
(3)海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:

其中分离步骤①、②、③所用分别为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘 。活性炭吸附法是工业提碘的方法之一,其流程如下:
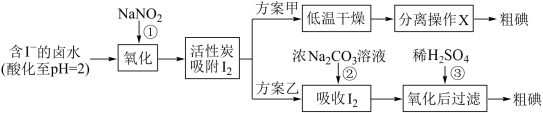
资料显示:
I.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成 NO
II. I2+5Cl2+6H2O = 2HIO3+10HCl,5 +2
+2 +2H+ = I2+5
+2H+ = I2+5 +H2O
+H2O
(1)反应①的离子方程式_______________ 。
(2)方案甲中,根据I2的特性,分离操作 X 的方法是_______ 。
(3)已知:反应②中每吸收3molI2转移5mol电子,离子方程式是_________ 。
(4)Cl2、酸性 KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是________ 。

资料显示:
I.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成 NO
II. I2+5Cl2+6H2O = 2HIO3+10HCl,5
 +2
+2 +2H+ = I2+5
+2H+ = I2+5 +H2O
+H2O(1)反应①的离子方程式
(2)方案甲中,根据I2的特性,分离操作 X 的方法是
(3)已知:反应②中每吸收3molI2转移5mol电子,离子方程式是
(4)Cl2、酸性 KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是
您最近一年使用:0次



