配平下列方程式或完成下列问题
(1)______ClO-+______Fe(OH)3+_______OH-=______Cl-+______FeO +______H2O。
+______H2O。________ 。
(2)______FeS2+______O2 ______Fe2O3+______SO2。
______Fe2O3+______SO2。________ 。
(3)____KI+____KIO3+____H2SO4=____I2+____K2SO4+____H2O。________ 。
(4)____S+____KOH=____K2S+____K2SO3+____H2O。________ 。
(5)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+______Cl2+______ =______K2CO3+______N2+______KCl+______
=______K2CO3+______N2+______KCl+______ 。
。________ 。
(6)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_____________ 。
(7)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
写出有关反应的化学方程式:___________________________ 。
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的 、NO转化为:
、NO转化为: 、
、 。当烟气中
。当烟气中 和NO的体积比为2:1时,其离子方程式为
和NO的体积比为2:1时,其离子方程式为___________ 。
(9)研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4·2H2O)的途径如图所示:
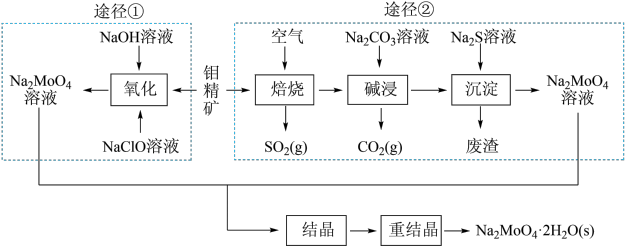
回答下列问题:
途径①制备钼酸钠溶液,同时有SO 生成,该反应的离子方程式为
生成,该反应的离子方程式为_____________ 。
(1)______ClO-+______Fe(OH)3+_______OH-=______Cl-+______FeO
 +______H2O。
+______H2O。(2)______FeS2+______O2
 ______Fe2O3+______SO2。
______Fe2O3+______SO2。(3)____KI+____KIO3+____H2SO4=____I2+____K2SO4+____H2O。
(4)____S+____KOH=____K2S+____K2SO3+____H2O。
(5)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+______Cl2+______
 =______K2CO3+______N2+______KCl+______
=______K2CO3+______N2+______KCl+______ 。
。(6)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(7)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
写出有关反应的化学方程式:
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的
 、NO转化为:
、NO转化为: 、
、 。当烟气中
。当烟气中 和NO的体积比为2:1时,其离子方程式为
和NO的体积比为2:1时,其离子方程式为(9)研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4·2H2O)的途径如图所示:

回答下列问题:
途径①制备钼酸钠溶液,同时有SO
 生成,该反应的离子方程式为
生成,该反应的离子方程式为
更新时间:2023-08-24 22:34:40
|
【知识点】 氧化还原反应方程式的配平解读
相似题推荐
填空题
|
较难
(0.4)
【推荐1】储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应中的反应物和生成物有C、CO2、H2SO4、KCr2O7、Cr2(SO4)2、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,所具的性质有_____
①丁达尔效应②加入饱和(NH4)2SO4溶液产生聚沉③可通过半透膜
(2)请用上述物质填空,配平化学方程式,并标出电子转移的方向和数目( ) C+_______ +_____ H2SO4→____ K2SO4+______ +_____ Cr2(SO4)3+____ H2O
(3)将标准状况下4.48 L产生的气体通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0g。
(I)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入该气体___ g。
(Ⅱ)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是______ 或________ 。
②若只能加入0.10 mol某物质,则加入的物质可以是______ 或________ 。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,所具的性质有
①丁达尔效应②加入饱和(NH4)2SO4溶液产生聚沉③可通过半透膜
(2)请用上述物质填空,配平化学方程式,并标出电子转移的方向和数目
(3)将标准状况下4.48 L产生的气体通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0g。
(I)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入该气体
(Ⅱ)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是
②若只能加入0.10 mol某物质,则加入的物质可以是
您最近一年使用:0次
【推荐2】按要求填空:
(1)还原铁粉与高温水蒸气反应的化学方程式:_____________________________________ ;
(2)除去Mg粉中的Al粉的试剂是__________ ,反应的离子方程式为:____________ ;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____ Fe(OH)3 +____ ClO-+____ OH- =__ FeO42-+___ Cl-+__ ( )
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是________________ ;还原剂是_______________ ;当有11molP参加反应,转移的电子的物质的量为________ ;1molCuSO4能氧化的P原子的数目为_____________ 。
(1)还原铁粉与高温水蒸气反应的化学方程式:
(2)除去Mg粉中的Al粉的试剂是
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】铜是与人类关系非常密切的有色金属。已知:常温下,在溶液中 稳定,
稳定,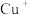 易在酸性条件下发生反应:
易在酸性条件下发生反应: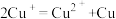 。大多数+1价铜的化合物是难溶物,
。大多数+1价铜的化合物是难溶物,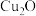 、CuI、CuCl、CuH等。
、CuI、CuCl、CuH等。
(1)在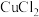 溶液中逐滴加入过量KI溶液可能发生以下反应:
溶液中逐滴加入过量KI溶液可能发生以下反应:
a.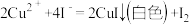
b.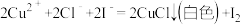 。
。
为顺利观察到白色沉淀可以加入的最佳试剂是________ 。
A.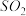 B.苯 C.NaOH溶液 D.乙醇
B.苯 C.NaOH溶液 D.乙醇
(2)一定条件下,在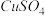 中加入
中加入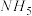 反应生成氢化亚铜(CuH)。
反应生成氢化亚铜(CuH)。
①已知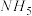 是离子化合物且所有原子都达到稀有气体的稳定结构,写出
是离子化合物且所有原子都达到稀有气体的稳定结构,写出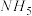 的电子式:
的电子式:__________ 。
②写出CuH在过量稀盐酸中有气体生成的离子方程式:____________ 。
(3)纳米级 具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。
具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。
方法一:在新制 浊液中滴入
浊液中滴入 水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。
水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。
①写出上述制备过程中的总反应方程式:_____________ 。
方法二:以铜作阳极,石墨作阴极电解。已知:铜作阳极时,铜先被氧化生成 ,后
,后 继续氧化生成
继续氧化生成 ;在碱性溶液中CuCl浊液易转化为
;在碱性溶液中CuCl浊液易转化为 。
。
②以NaOH溶液作为电解质溶液时需添加NaCl,其目的是______________ ,写出阳极反应式:______________ 。
③写出在碱性溶液中CuCl浊液转化为 的离子方程式:
的离子方程式:____________ 。
④这样制得的 中往往含有CuCl,请设计实验证明CuCl的存在:
中往往含有CuCl,请设计实验证明CuCl的存在:_________ 。
 稳定,
稳定,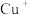 易在酸性条件下发生反应:
易在酸性条件下发生反应: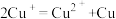 。大多数+1价铜的化合物是难溶物,
。大多数+1价铜的化合物是难溶物,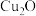 、CuI、CuCl、CuH等。
、CuI、CuCl、CuH等。(1)在
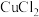 溶液中逐滴加入过量KI溶液可能发生以下反应:
溶液中逐滴加入过量KI溶液可能发生以下反应:a.
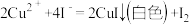
b.
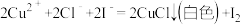 。
。为顺利观察到白色沉淀可以加入的最佳试剂是
A.
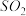 B.苯 C.NaOH溶液 D.乙醇
B.苯 C.NaOH溶液 D.乙醇(2)一定条件下,在
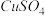 中加入
中加入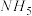 反应生成氢化亚铜(CuH)。
反应生成氢化亚铜(CuH)。①已知
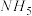 是离子化合物且所有原子都达到稀有气体的稳定结构,写出
是离子化合物且所有原子都达到稀有气体的稳定结构,写出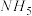 的电子式:
的电子式:②写出CuH在过量稀盐酸中有气体生成的离子方程式:
(3)纳米级
 具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。
具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。方法一:在新制
 浊液中滴入
浊液中滴入 水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。
水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。①写出上述制备过程中的总反应方程式:
方法二:以铜作阳极,石墨作阴极电解。已知:铜作阳极时,铜先被氧化生成
 ,后
,后 继续氧化生成
继续氧化生成 ;在碱性溶液中CuCl浊液易转化为
;在碱性溶液中CuCl浊液易转化为 。
。②以NaOH溶液作为电解质溶液时需添加NaCl,其目的是
③写出在碱性溶液中CuCl浊液转化为
 的离子方程式:
的离子方程式:④这样制得的
 中往往含有CuCl,请设计实验证明CuCl的存在:
中往往含有CuCl,请设计实验证明CuCl的存在:
您最近一年使用:0次



