回答下列问题。
Ⅰ.下图为在某催化剂表面合成氨反应机理。
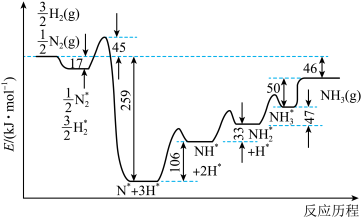
(1)图中决速步骤(即速率最慢步骤)的化学方程式为___________ 。
(2)反应 的
的
___________ kJ/mol。
Ⅱ.元素铬(Cr)在溶液中主要以 (蓝紫色)、
(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(3) 与
与 的化学性质相似,在
的化学性质相似,在 溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是___________ 。
(4) 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的
在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的 溶液中(
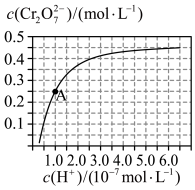
溶液中(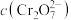 )随
)随 的)的变化如图所示。
的)的变化如图所示。
①用离子方程式表示 溶液中的转化反应
溶液中的转化反应___________ 。
②由图可知,溶液酸性增大, 的平衡转化率
的平衡转化率___________ (填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________ 。
③升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
___________ 0(填“大于”“小于”或“等于”)。
(5)+6价铬的化合物毒性较大,常用 将废液中的
将废液中的 还原成
还原成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
Ⅰ.下图为在某催化剂表面合成氨反应机理。

(1)图中决速步骤(即速率最慢步骤)的化学方程式为
(2)反应
 的
的
Ⅱ.元素铬(Cr)在溶液中主要以
 (蓝紫色)、
(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:(3)
 与
与 的化学性质相似,在
的化学性质相似,在 溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是(4)
 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的
在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的 溶液中(
溶液中(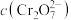 )随
)随 的)的变化如图所示。
的)的变化如图所示。
①用离子方程式表示
 溶液中的转化反应
溶液中的转化反应②由图可知,溶液酸性增大,
 的平衡转化率
的平衡转化率③升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(5)+6价铬的化合物毒性较大,常用
 将废液中的
将废液中的 还原成
还原成 ,反应的离子方程式为
,反应的离子方程式为
更新时间:2023-10-15 21:49:00
|
【知识点】 化学反应原理综合考查解读
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】含金贮氢材料具有优异的吸放氢性能,在配合氢能开发中起着关键作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐渐增大:在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:Hx(s)+yH2(g)=MHx+2y(s) ΔH1(I);在B点,氢化反应结束,进步一增大氢气压强,H/M几乎不变。反应(I)的焓变ΔH1___ 0(填“>”、“=”或“<”)。在恒温恒容的密闭容器中,该反应达到化学平衡时,下列有关叙述正确的是___ 。
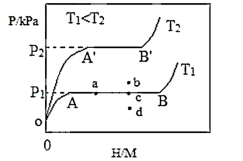
a.容器内气体压强保持不变
b.吸收ymolH2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(2)η表示单位质量贮氢合金在氢化还原反应阶段的最大吸氢量占总吸氢量的比例,则温度为T1、T2时,η(T1)________ (填“>”、“=”或“<”)η(T2)。当反应(I)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(I)可能处于图中的______ 点(填“a”、“b”、“c”或“d”),该贮氢合金可通过______ 的方式释放氢气。
(3)用吸收H2后的贮氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池间相正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,负极的电极反应式为________ 。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为___ 。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐渐增大:在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:Hx(s)+yH2(g)=MHx+2y(s) ΔH1(I);在B点,氢化反应结束,进步一增大氢气压强,H/M几乎不变。反应(I)的焓变ΔH1

a.容器内气体压强保持不变
b.吸收ymolH2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(2)η表示单位质量贮氢合金在氢化还原反应阶段的最大吸氢量占总吸氢量的比例,则温度为T1、T2时,η(T1)
(3)用吸收H2后的贮氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池间相正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)+MH
 Ni(OH)2+M
Ni(OH)2+M①电池放电时,负极的电极反应式为
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】利用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1) 甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ.CH3OH(g)+H2O(g)⇌3H2(g)+CO2(g);ΔH1
反应Ⅱ.H2(g)+CO2(g)⇌H2O(g)+CO(g);ΔH2=a kJ·mol-1
反应Ⅲ.CH3OH(g)⇌2H2(g)+CO(g);ΔH3=b kJ·mol-1
反应Ⅳ.2CH3OH(g)⇌2H2O(g)+C2H4(g);ΔH4=c kJ·mol-1
①ΔH1=___________ kJ·mol-1。
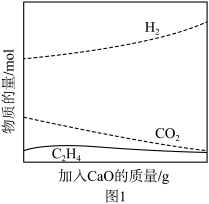
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,加入CaO提高氢气产率的原因是___________ 。
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中 对反应的选择性影响如图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制 =
=___________ ;当 =0.25时,CH3OH和O2发生的主要反应方程式为
=0.25时,CH3OH和O2发生的主要反应方程式为___________ 。

(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1 000 kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90 min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是___________ 。

(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。

①电源的正极为___________ (填“A”或“B”)。
②阴极的电极反应式为___________ 。
(1) 甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ.CH3OH(g)+H2O(g)⇌3H2(g)+CO2(g);ΔH1
反应Ⅱ.H2(g)+CO2(g)⇌H2O(g)+CO(g);ΔH2=a kJ·mol-1
反应Ⅲ.CH3OH(g)⇌2H2(g)+CO(g);ΔH3=b kJ·mol-1
反应Ⅳ.2CH3OH(g)⇌2H2O(g)+C2H4(g);ΔH4=c kJ·mol-1
①ΔH1=
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,加入CaO提高氢气产率的原因是

③在一定条件下用氧气催化氧化甲醇制氢气,原料气中
 对反应的选择性影响如图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制 =
= =0.25时,CH3OH和O2发生的主要反应方程式为
=0.25时,CH3OH和O2发生的主要反应方程式为
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1 000 kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90 min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是

(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。

①电源的正极为
②阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:_______ 。
_____C+____KMnO4+_____H2SO4→_____CO2↑+_____MnSO4+_____K2SO4+_____H2O
(2)将不同量的CO和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下两组数据:
①实验2条件下平衡常数K=_______ 。
②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v正_______ v逆(填“ ”、“=”或“
”、“=”或“ ”)。
”)。
③由两组实验结果,可判断该反应的正反应ΔH_______ 0(填“ ”、“=”或“
”、“=”或“ ”)。
”)。
(3)已知在常温常压下:
①CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ/mol
③H2O(g)=4H2O(l) ΔH=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______ 。
(4)对于反应2CO(g)=2C(s)+O2(g)
①已知该反应的△H 0,简述该设想能否实现的依据:
0,简述该设想能否实现的依据:_______ 。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为____ 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9,CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1.0×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_______ mol/L。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
_____C+____KMnO4+_____H2SO4→_____CO2↑+_____MnSO4+_____K2SO4+_____H2O
(2)将不同量的CO和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度 | 起始量mol | 平衡量mol | 达到平衡 所需时间 | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验2条件下平衡常数K=
②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v正
 ”、“=”或“
”、“=”或“ ”)。
”)。③由两组实验结果,可判断该反应的正反应ΔH
 ”、“=”或“
”、“=”或“ ”)。
”)。(3)已知在常温常压下:
①CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ/mol
③H2O(g)=4H2O(l) ΔH=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(4)对于反应2CO(g)=2C(s)+O2(g)
①已知该反应的△H
 0,简述该设想能否实现的依据:
0,简述该设想能否实现的依据:②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9,CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1.0×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次



