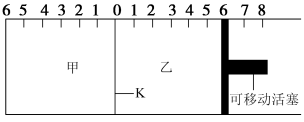
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应: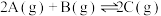 ,反应达到平衡后,恢复到反应发生前时的温度。下列有关说法错误的是
,反应达到平衡后,恢复到反应发生前时的温度。下列有关说法错误的是
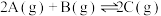 ,反应达到平衡后,恢复到反应发生前时的温度。下列有关说法错误的是
,反应达到平衡后,恢复到反应发生前时的温度。下列有关说法错误的是
| A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |
| B.达到平衡后,隔板K最终停留在左侧刻度2-0之间 |
| C.若平衡时K停留在左侧1刻度处,则活塞停留在右侧5-6刻度之间 |
| D.若一开始就将K和可移动活塞都固定,其他条件均不变,则达到平衡时甲中A的转化率与乙中C的转化率一定相等 |
更新时间:2023-10-14 08:57:24
|
【知识点】 等效平衡理论的综合应用解读
相似题推荐
多选题
|
较难
(0.4)
【推荐1】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g) 2NH3(g) △H<0相关数据如下表所示下列说法正确的是
2NH3(g) △H<0相关数据如下表所示下列说法正确的是
 2NH3(g) △H<0相关数据如下表所示下列说法正确的是
2NH3(g) △H<0相关数据如下表所示下列说法正确的是| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molN2、3mol的H2 | 2mol的NH3 | 2mol的NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应平衡常数K=c2(NH3)/c(N2)∙c3(H2) | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度(mol/L) | C甲 | C乙 | C丙 |
| 平衡时NH3的反应速率(mol/L∙min) | v甲 | v乙 | v丙 |
| A.V甲>V乙 | B.K乙>K丙 | C.c乙>c甲 | D.υ甲=υ丙 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐2】在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如右下图所示。
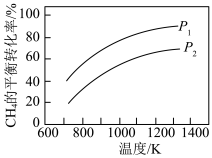
下列说法错误的是
| 容器 | 起始物质的量/mol | CH4的平均转化率 | |||
| CH4 | H2O | CO | H2 | ||
| I | 0.1 | 0.1 | 0 | 0 | 50% |
| II | 0.1 | 0.1 | 0.1 | 0.3 | |
| III | 0 | 0.1 | 0.2 | 0.6 | |

下列说法错误的是
| A.该反应的ΔH>0,图中压强P1>P2 |
| B.起始时,容器Ⅱ中v(CH4)正<v(CH4)逆 |
| C.达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ<2n(CO)Ⅰ |
| D.达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比:pⅡ∶pⅢ=4∶5 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐3】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g) 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
下列说法正确的是
 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol A2、3molB2 | 2molAB3 | 2mol AB3 |
| 反应物的转化率 |
|
|
|
反应的平衡常数K=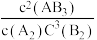 | K甲 | K乙 | K丙 |
| 平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
| 平衡时AB3的反应速率/mol·L-1·min-1 |
|
|
|
下列说法正确的是
| A.K乙>K丙 | B.c乙=c丙 | C. 甲= 甲= 丙 丙 | D. 甲 + 甲 + 乙<1 乙<1 |
您最近一年使用:0次



