通过化学的方法实现 的资源化利用是一种非常理想的
的资源化利用是一种非常理想的 减排途径。
减排途径。
(1)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:

 kJ/mol;
kJ/mol;

 kJ/mol。
kJ/mol。
写出 和
和 转化为
转化为 和
和 的热化学方程式:
的热化学方程式:___________ 。
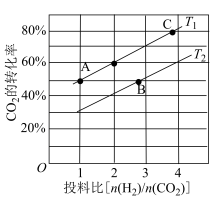
(2)在某压强下,合成二甲醚的反应在不同温度、不同投料比时, 的平衡转化率如图所示。
的平衡转化率如图所示。 温度下,将6 mol
温度下,将6 mol  和12 mol
和12 mol  充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率
充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率
___________ ; 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为___________ 。
(3)若
 kJ⋅mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是
kJ⋅mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是___________ (填序号)。
A.CO和 的物质的量浓度之比是1∶2
的物质的量浓度之比是1∶2
B.CO的消耗速率等于 的生成速率的2倍
的生成速率的2倍
C.容器中混合气体的体积保持不变
D.容器中混合气体的平均摩尔质量保持不变
E.容器中混合气体的密度保持不变
(4)电解法实现 制备甲醇(
制备甲醇( )
)
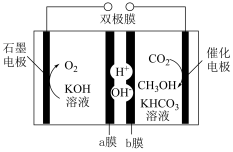
石墨电极上的电极反应式为___________ ,a膜为___________ (填阴离子交换膜或阳离子交换膜),电解过程中右室溶液中 的物质的量
的物质的量___________ (填增大、减小、不变)。
 的资源化利用是一种非常理想的
的资源化利用是一种非常理想的 减排途径。
减排途径。(1)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:
 kJ/mol;
kJ/mol;
 kJ/mol。
kJ/mol。写出
 和
和 转化为
转化为 和
和 的热化学方程式:
的热化学方程式:(2)在某压强下,合成二甲醚的反应在不同温度、不同投料比时,
 的平衡转化率如图所示。
的平衡转化率如图所示。 温度下,将6 mol
温度下,将6 mol  和12 mol
和12 mol  充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率
充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率
 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为
(3)若

 kJ⋅mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是
kJ⋅mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是A.CO和
 的物质的量浓度之比是1∶2
的物质的量浓度之比是1∶2B.CO的消耗速率等于
 的生成速率的2倍
的生成速率的2倍C.容器中混合气体的体积保持不变
D.容器中混合气体的平均摩尔质量保持不变
E.容器中混合气体的密度保持不变
(4)电解法实现
 制备甲醇(
制备甲醇( )
)
石墨电极上的电极反应式为
 的物质的量
的物质的量
更新时间:2023-12-15 07:48:53
|
【知识点】 化学反应原理综合考查解读
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:
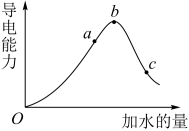
①写出醋酸的电离方程式_______ 。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为_______ 。
③a、b、c三点中醋酸的电离程度最大的是_______ 。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:c(H+)甲_______ 10C(H+)乙(填“大于”、“小于”或 “等于”),
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 | 平衡移动方向 | c(OH-) | c(CH3COO-) |
| 升温 | 不 | 不填 | |
| 加水 | 不填 | ||
| 加盐酸 | 不填 | ||
| 加少量氢氧化钠固体 | 不填 | 不填 |
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:

①写出醋酸的电离方程式
②a、b、c三点溶液中氢离子浓度由小到大的顺序为
③a、b、c三点中醋酸的电离程度最大的是
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:c(H+)甲
您最近一年使用:0次
【推荐2】(1)向某体积固定的密闭容器中加入0.3 A、0.1
A、0.1 C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

①若t1=15,则t0-t1内反应速率v(C) =___________ ,A的转化率为___________ ;
②写出反应的化学方程式:___________
③B的起始的物质的量是___________ mol;平衡时体系内的压强为初始状态的___________ 倍。
(2)已知断裂几种化学键要吸收的能量如下:
16 gCH4在O2中完全燃烧生成气态CO2和气态水时___________ (填“吸收”或 “放出”)约__________ kJ热量。
(3)燃料电池是一种高效、环境友好的供电装置,如图为甲烷燃料电池的工作原理示意图,a、b均为惰性电极。
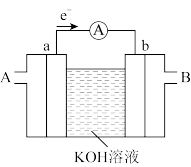
①使用时,空气从___________ 口通入(填“A”或“B”);
②a极的电极反应为:___________ 。
 A、0.1
A、0.1 C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①若t1=15,则t0-t1内反应速率v(C) =
②写出反应的化学方程式:
③B的起始的物质的量是
(2)已知断裂几种化学键要吸收的能量如下:
| 化学键 | C—H | O=O | C=O | H—O |
| 断裂1mol键吸收的能量/kJ | 415 | 497 | 745 | 463 |
16 gCH4在O2中完全燃烧生成气态CO2和气态水时
(3)燃料电池是一种高效、环境友好的供电装置,如图为甲烷燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从
②a极的电极反应为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
真题
【推荐3】化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g) TaI4(g)+S2(g) △H>0(Ⅰ),反应(Ⅰ)的平衡常数表达式K=
TaI4(g)+S2(g) △H>0(Ⅰ),反应(Ⅰ)的平衡常数表达式K=______ ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为______ 。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1______ T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是______ 。

(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为______ ,滴定反应的离子方程式为______ 。
(4)25℃时,H2SO3
 +H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=
+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=______ mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中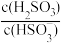 将
将______ (填“增大”“减小”或“不变”)。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g)
 TaI4(g)+S2(g) △H>0(Ⅰ),反应(Ⅰ)的平衡常数表达式K=
TaI4(g)+S2(g) △H>0(Ⅰ),反应(Ⅰ)的平衡常数表达式K=(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1

(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为
(4)25℃时,H2SO3

 +H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=
+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=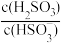 将
将
您最近一年使用:0次



