回答下列问题:
(1)已知下列热化学方程式:
①
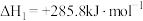
②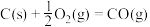
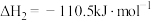
③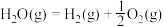
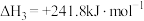
上述反应中属于放热反应的是__________ 。
(2)①的反应过程是太阳光催化分解水制氢气,该反应中主要能量转化形式为_________ 。
a.太阳能转化为化学能 b.化学能转化为电能
(3)若反应③使用催化剂,那么 将
将_______ (填“增大”“减小”或“不变”)
(4)反应 的
的
______  。
。
(5) 气态高能燃料乙硼烷
气态高能燃料乙硼烷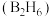 在氧气中燃烧,生成固态三氧化二硼
在氧气中燃烧,生成固态三氧化二硼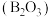 和气态水,释放
和气态水,释放 的热。
的热。
①写出反应的热化学方程式____________ 。
②11.2L(标准状况)气态乙硼烷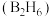 完全燃烧生成液态水生成的热
完全燃烧生成液态水生成的热_______  。
。
(1)已知下列热化学方程式:
①

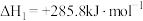
②
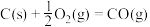
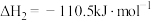
③
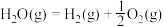
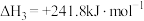
上述反应中属于放热反应的是
(2)①的反应过程是太阳光催化分解水制氢气,该反应中主要能量转化形式为
a.太阳能转化为化学能 b.化学能转化为电能
(3)若反应③使用催化剂,那么
 将
将(4)反应
 的
的
 。
。(5)
 气态高能燃料乙硼烷
气态高能燃料乙硼烷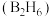 在氧气中燃烧,生成固态三氧化二硼
在氧气中燃烧,生成固态三氧化二硼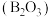 和气态水,释放
和气态水,释放 的热。
的热。①写出反应的热化学方程式
②11.2L(标准状况)气态乙硼烷
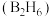 完全燃烧生成液态水生成的热
完全燃烧生成液态水生成的热 。
。
更新时间:2023-12-27 12:21:56
|
相似题推荐
【推荐1】一定的温度和压力下,1mol溶质溶解于某溶剂中产生的热效应,叫做该物质的溶解热。称取等质量(ag)的胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。
(1)胆矾的溶解热△H=___ kJ·mol-1。
(2)无水硫酸铜的溶解热△H=___ kJ·mol-1。
(3)从以上数据可知,胆矾脱水是___ 过程,1mol胆矾脱水需___ kJ的热量。
(1)胆矾的溶解热△H=
(2)无水硫酸铜的溶解热△H=
(3)从以上数据可知,胆矾脱水是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】天然气高温条件下可以转化为氢气,发生反应的热化学方程式为: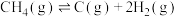
 。
。
回答下列问题:
(1)反应的平衡常数表达式为
___________ ;已知几种物质的燃烧热如下表所示,则反应的
___________ kJ·mol-1。
(2)一定温度下,在容积不变的密闭容器中充入适量 发生上述反应,下列情况能说明反应达到平衡状态的是
发生上述反应,下列情况能说明反应达到平衡状态的是___________ (填序号)。
a.反应总压强不随时间变化 b.气体密度不随时间变化
c.CH₄体积分数不随时间变化 d. 的消耗速率与
的消耗速率与 的生成速率之比为1∶2
的生成速率之比为1∶2
(3)在体积为2L的密闭容器中充入1mol 发生上述反应,不同温度下测得
发生上述反应,不同温度下测得 的转化率随时间的变化关系如下表所示:
的转化率随时间的变化关系如下表所示:
①
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 条件下,前2min内,用
条件下,前2min内,用 表示的化学反应速率
表示的化学反应速率
___________ mol⋅L-1⋅min-1;达平衡时 的体积分数为
的体积分数为___________ %(结果保留1位小数)。
(4)一定温度,100kPa条件下,向密闭容器中充入 、Ar气混合气体,
、Ar气混合气体, 的转化率与
的转化率与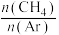 的关系如图所示。
的关系如图所示。
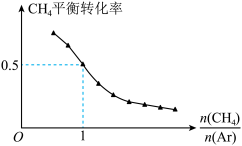
①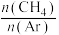 增大,
增大, 平衡转化率减小的原因是
平衡转化率减小的原因是___________ 。
②此温度下,该反应的分压平衡常数
___________ 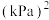 。
。
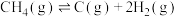
 。
。回答下列问题:
(1)反应的平衡常数表达式为


| 可燃物 |  | 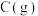 |  |
燃烧热/kJ·mol | -890.3 | -393.5 | -285.8 |
(2)一定温度下,在容积不变的密闭容器中充入适量
 发生上述反应,下列情况能说明反应达到平衡状态的是
发生上述反应,下列情况能说明反应达到平衡状态的是a.反应总压强不随时间变化 b.气体密度不随时间变化
c.CH₄体积分数不随时间变化 d.
 的消耗速率与
的消耗速率与 的生成速率之比为1∶2
的生成速率之比为1∶2(3)在体积为2L的密闭容器中充入1mol
 发生上述反应,不同温度下测得
发生上述反应,不同温度下测得 的转化率随时间的变化关系如下表所示:
的转化率随时间的变化关系如下表所示:时间/min 转化率 转化率温度/℃ | 2 | 4 | 6 | 8 | 10 |
 | 40% | 60% | 80% | 80% | 80% |
 | 20% | 30% | 40% | 60% | 60% |

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 条件下,前2min内,用
条件下,前2min内,用 表示的化学反应速率
表示的化学反应速率
 的体积分数为
的体积分数为(4)一定温度,100kPa条件下,向密闭容器中充入
 、Ar气混合气体,
、Ar气混合气体, 的转化率与
的转化率与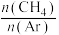 的关系如图所示。
的关系如图所示。
①
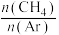 增大,
增大, 平衡转化率减小的原因是
平衡转化率减小的原因是②此温度下,该反应的分压平衡常数

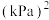 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
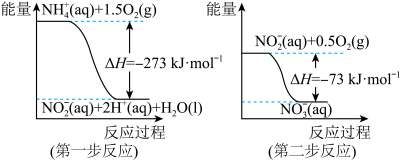
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是_______ 。
②1mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_________________________ 。
(2) 已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1_____ ΔH2(填“>”“<”或“=”)。
(3) 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ•mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ•mol-1 ②
O2(g) ΔH=-226 kJ•mol-1 ②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为__________________ 。
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ•mol-1,蒸发1mol Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
则表中a=__________________ 。
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(2) 已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1
(3) 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ•mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) ΔH=-226 kJ•mol-1 ②
O2(g) ΔH=-226 kJ•mol-1 ②则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ•mol-1,蒸发1mol Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

①第一步反应是___________ (填“放热”或“吸热”)反应。
② 全部氧化成
全部氧化成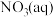 的热化学方程式是
的热化学方程式是___________ 。
(2)化学反应中的焓变与反应物和生成物的键能(E)有关。 、
、 下,已知1g氢气完全燃烧生成液态水时放出
下,已知1g氢气完全燃烧生成液态水时放出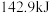 的热量,表示氢气燃烧热的热化学方程式是
的热量,表示氢气燃烧热的热化学方程式是___________ 。已知:E(H-H)=436kJ/mol,E(O=O)=498 kJ/mol,则E(H-O)=___________ 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
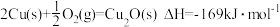 ;
;
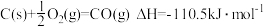 ;
;
 。
。
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为___________ 。若反应过程中转移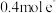 ,则该反应吸收的热量为
,则该反应吸收的热量为___________ kJ。
(4)充分燃烧一定量的丁烷 放出的热量大小为Q生成的CO2恰好与
放出的热量大小为Q生成的CO2恰好与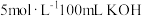 溶液完全反应生成正盐。则完全燃烧1mol丁烷放出的热量X=
溶液完全反应生成正盐。则完全燃烧1mol丁烷放出的热量X=___________ 。
(1)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②
 全部氧化成
全部氧化成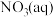 的热化学方程式是
的热化学方程式是(2)化学反应中的焓变与反应物和生成物的键能(E)有关。
 、
、 下,已知1g氢气完全燃烧生成液态水时放出
下,已知1g氢气完全燃烧生成液态水时放出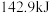 的热量,表示氢气燃烧热的热化学方程式是
的热量,表示氢气燃烧热的热化学方程式是(3)纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
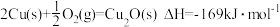 ;
;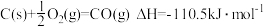 ;
; 。
。则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
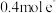 ,则该反应吸收的热量为
,则该反应吸收的热量为(4)充分燃烧一定量的丁烷
 放出的热量大小为Q生成的CO2恰好与
放出的热量大小为Q生成的CO2恰好与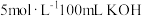 溶液完全反应生成正盐。则完全燃烧1mol丁烷放出的热量X=
溶液完全反应生成正盐。则完全燃烧1mol丁烷放出的热量X=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】载人航天器中,可将航天员呼出的CO2转化为 H2O,再通过电解 H2O 获得 O2,实现 O2的再 生,同时还能制备CH4。
已知:①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H =-252.9kJ/mol
②2H2O(l)=2H2(g)+O2(g) ∆H=+571.6kJ/mol
请回答下列问题:
(1)反应①属于___________ (填“吸热”或“放热”)反应。
(2)反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H=___________ kJ/mol。
(3)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
已知:①2CH4(g)=C2H4(g)+2H2(g) ΔH=+167kJ/mol,则a=___________ 。
②已知5C2H4(g)+12 (aq)+36H+(aq)=12Mn2+(aq)+10CO2 (g)+28H2O(l) ΔH=-m kJ·mol-1,当放出的热量为m kJ时,该反应转移电子的物质的量为
(aq)+36H+(aq)=12Mn2+(aq)+10CO2 (g)+28H2O(l) ΔH=-m kJ·mol-1,当放出的热量为m kJ时,该反应转移电子的物质的量为___________ mol。
③制备合成气反应历程分两步,步骤I:CH4(g) C(ads)+2H2(g);步骤Ⅱ:C(ads)+CO2(g)⇌2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图:
C(ads)+2H2(g);步骤Ⅱ:C(ads)+CO2(g)⇌2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图:
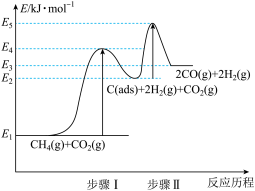
E4-E1表示步骤I正反应的___________ ,制备合成气反应可在___________ (填“高温” 或“低温”)下自发进行。
已知:①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H =-252.9kJ/mol
②2H2O(l)=2H2(g)+O2(g) ∆H=+571.6kJ/mol
请回答下列问题:
(1)反应①属于
(2)反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H=
(3)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
| 化学键 | H-H | C=C | C-C | C-H |
| E(kJ/mol) | 436 | a | 348 | 413 |
②已知5C2H4(g)+12
 (aq)+36H+(aq)=12Mn2+(aq)+10CO2 (g)+28H2O(l) ΔH=-m kJ·mol-1,当放出的热量为m kJ时,该反应转移电子的物质的量为
(aq)+36H+(aq)=12Mn2+(aq)+10CO2 (g)+28H2O(l) ΔH=-m kJ·mol-1,当放出的热量为m kJ时,该反应转移电子的物质的量为③制备合成气反应历程分两步,步骤I:CH4(g)
 C(ads)+2H2(g);步骤Ⅱ:C(ads)+CO2(g)⇌2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图:
C(ads)+2H2(g);步骤Ⅱ:C(ads)+CO2(g)⇌2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图:
E4-E1表示步骤I正反应的
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某学习小组对化学反应2Al+3H2SO4 = Al2(SO4)3+ 3H2↑进行研究。
(1)该反应的还原剂是________ ,发生_________ 反应(填“氧化”或“还原”)。若将该反应设计成原电池,用铜作电极材料之一,铜电极上的现象为_________ 。
(2)该反应的能量变化如下图所示。该反应为__________ 反应(填“吸热”或“放热”)。
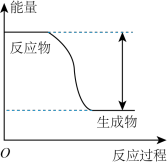
(3)下列措施中,能加快化学反应速率的是_________ (填字母序号)。
a 用等质量的铝粉代替铝块
b 将反应的试管放置在冰水中
c 往容器中加少量Na2SO4固体
d 往稀硫酸溶液中添加几滴98%的浓硫酸
(4)足量铝与20mL1.0mol/L稀硫酸的反应过程中,某20s内共收集到气体44.8mL(已换算成标况下)。请选用合适的物质表示此20s内的化学反应速率:______ 。
(1)该反应的还原剂是
(2)该反应的能量变化如下图所示。该反应为

(3)下列措施中,能加快化学反应速率的是
a 用等质量的铝粉代替铝块
b 将反应的试管放置在冰水中
c 往容器中加少量Na2SO4固体
d 往稀硫酸溶液中添加几滴98%的浓硫酸
(4)足量铝与20mL1.0mol/L稀硫酸的反应过程中,某20s内共收集到气体44.8mL(已换算成标况下)。请选用合适的物质表示此20s内的化学反应速率:
您最近一年使用:0次



