过氧化钠因吸收空气里的二氧化碳和水而变质,某兴趣小组对久置的过氧化钠样品M进行实验探究。
实验I:甲同学设计下图所示装置探究样品M的变质情况。___________ 。
(2)装置C中的溶液是___________ ,能代替C的试剂是___________ 。
(3)若B中___________ ,D中___________ ,则样品M部分变质。
实验Ⅱ:乙同学用氯化钡溶液作为检验试剂进行实验。
(4)根据产生白色沉淀,乙同学认为样品M已变质,该反应的离子方程式为___________ 。
资料显示, 能与
能与 、NaOH溶液反应生成白色不溶物
、NaOH溶液反应生成白色不溶物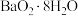 。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
实验Ⅲ:取少量纯净的过氧化钠固体溶于蒸馏水,先加入过量稀硫酸,再滴入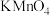 溶液。实验证明
溶液。实验证明 与水反应有
与水反应有 生成。
生成。
(5)滴入 溶液后观察到的现象是
溶液后观察到的现象是________ ,此反应的离子方程式为________ 。
丙同学利用如图装置进行实验,排除了 的干扰。
的干扰。
(6)请补充完整上述实验的操作过程:___________ 。
实验I:甲同学设计下图所示装置探究样品M的变质情况。
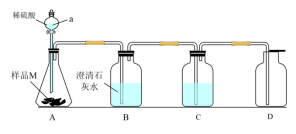
(2)装置C中的溶液是
(3)若B中
实验Ⅱ:乙同学用氯化钡溶液作为检验试剂进行实验。
(4)根据产生白色沉淀,乙同学认为样品M已变质,该反应的离子方程式为
资料显示,
 能与
能与 、NaOH溶液反应生成白色不溶物
、NaOH溶液反应生成白色不溶物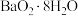 。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
。据此,丙同学对乙同学的检验结果提出质疑并进行实验。实验Ⅲ:取少量纯净的过氧化钠固体溶于蒸馏水,先加入过量稀硫酸,再滴入
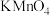 溶液。实验证明
溶液。实验证明 与水反应有
与水反应有 生成。
生成。(5)滴入
 溶液后观察到的现象是
溶液后观察到的现象是丙同学利用如图装置进行实验,排除了
 的干扰。
的干扰。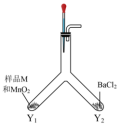
(6)请补充完整上述实验的操作过程:
23-24高三上·福建福州·阶段练习 查看更多[2]
更新时间:2024-01-02 16:48:11
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】钒(V)是人体必需的微量元素,能预防突发性心脏病等疾病,其常见化合价有+2、+3、+4、+5,实验室模拟工业生产制备V2(CO3)3的步骤如下:
I.取18.20gV2O5放入水中搅拌形成悬浊液,在酸性条件下,通入二氯化硫充分反应可得V2(SO4)3溶液;
II.将V2(SO4)3溶液与足量的碳酸钠溶液混合,充分反应后过滤,洗涤、干燥,得V2(CO3)3固体22.56g。
已知:+5价V具有氧化性,+3价V具有还原性,易被氧气氧化。
回答下列问题:
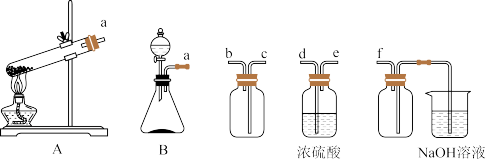
(1)实验室用Na2SO3固体和H2SO4(浓)制取SO2,可选用的发生装置是_____ (填“A”或“B”),利用下述装置制取并收集干燥的SO2,连接顺序为a—____ —____ —____ —_____ —f。
(2)步骤I的装置如下;
①盛放V2O5的仪器D的名称是_____ ,装置C中长颈漏斗的作用是_______ 。
②通入二氧化硫前和实验结束后都要通入N2,目的是________ 。
③写出步骤I中反应的离子方程式:___________ 。
(3)步骤II的洗涤操作中,证明已经洗净的方法是_________ ;实验中V2(CO3)3的产率为_______ 。
I.取18.20gV2O5放入水中搅拌形成悬浊液,在酸性条件下,通入二氯化硫充分反应可得V2(SO4)3溶液;
II.将V2(SO4)3溶液与足量的碳酸钠溶液混合,充分反应后过滤,洗涤、干燥,得V2(CO3)3固体22.56g。
已知:+5价V具有氧化性,+3价V具有还原性,易被氧气氧化。
回答下列问题:
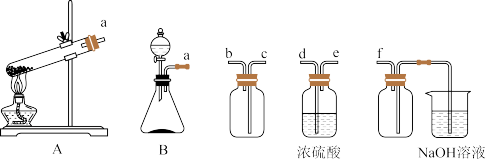
(1)实验室用Na2SO3固体和H2SO4(浓)制取SO2,可选用的发生装置是
(2)步骤I的装置如下;

①盛放V2O5的仪器D的名称是
②通入二氧化硫前和实验结束后都要通入N2,目的是
③写出步骤I中反应的离子方程式:
(3)步骤II的洗涤操作中,证明已经洗净的方法是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】碳酸镧La2(CO3)3(相对分子量为458)可用于治疗高磷酸盐血症,它为白色粉末、难溶于水、900℃物分解可生成La2O3(相对分子量为326)固体,在溶液中制备易形成水合碳酸镧La2(CO3)3·xH2O。溶液碱性太强时会生成受热易分解的碱式碳酸镧La(OH)CO3。
I.制备产品水合碳酸镧La2(CO3)3·xH2O:

(1)仪器X的名称为____ ,①中试管内发生反应的化学方程式为____ 。
(2)装置接口的连接顺序为a-_____ -f(填接口字母);
(3)为防止溶液碱性太强生成副产物La(OH)CO3,实验过程中应采取措施_____ ,该反应中生成副产物氯化铵,请写出生成水合碳酸镧的化学方程式:____ 。
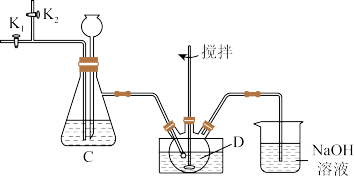
II.甲小组通过以下实验验证制得的样品中是否含La(OH)CO3,将石英玻璃A管称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g,将装有试剂的装置C称重,记为m3g。按如图连接好装置进行实验。
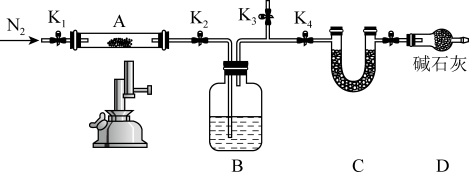
实验步骤:
①打开K1、K2和K3,缓缓通入N2;
②数分钟后关闭____,打开____,点燃酒精喷灯,加热A中样品;
③一段时间后,熄灭酒精灯,打开K1,通入N2数分钟后关闭K1和K2,冷却到室温,称量A。重复上述操作步骤,直至A恒重,记为m4g(此时装置A中为La2O3)。称重装置C,记为m5g。
(4)实验步骤②中关闭____ ,打开_____ 。(填写阀门代号)
(5)结果分析:当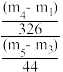 =
=____ 时,说明所得样品中不含有La(OH)CO3。
I.制备产品水合碳酸镧La2(CO3)3·xH2O:

(1)仪器X的名称为
(2)装置接口的连接顺序为a-
(3)为防止溶液碱性太强生成副产物La(OH)CO3,实验过程中应采取措施
II.甲小组通过以下实验验证制得的样品中是否含La(OH)CO3,将石英玻璃A管称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g,将装有试剂的装置C称重,记为m3g。按如图连接好装置进行实验。

实验步骤:
①打开K1、K2和K3,缓缓通入N2;
②数分钟后关闭____,打开____,点燃酒精喷灯,加热A中样品;
③一段时间后,熄灭酒精灯,打开K1,通入N2数分钟后关闭K1和K2,冷却到室温,称量A。重复上述操作步骤,直至A恒重,记为m4g(此时装置A中为La2O3)。称重装置C,记为m5g。
(4)实验步骤②中关闭
(5)结果分析:当
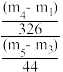 =
=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜(2NH3+3CuO N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2 g、生成氮气在标准状况下的体积V1 L。乙小组测得,洗气前装置D的质量m3 g、洗气后装置D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:________ 。
(2)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填在下表空格中。
(3)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为________ 。
(4)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是_________ 。

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜(2NH3+3CuO
 N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。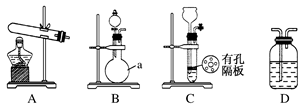
甲小组测得,反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2 g、生成氮气在标准状况下的体积V1 L。乙小组测得,洗气前装置D的质量m3 g、洗气后装置D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:
(2)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填在下表空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、 硫酸铵 | 反应的化学方程式为① |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 氢氧化钠溶于氨水后放热,增加氢氧根离子浓度,加快氨气逸出 |
(3)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为
(4)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】二氧化氯(ClO2)常用于处理含硫废水。某学习小组在实验室中探究ClO2与Na2S的反应。
已知:① ClO2是极易溶于水的黄绿色气体,有毒,沸点为11℃。
② SO2 + NaClO3 + H2SO4→ ClO2 + NaHSO4(未配平)。
③ ClO2 + NaOH→NaCl + NaClO3 + H2O(未配平)。
(1)设计如下装置制备ClO2:
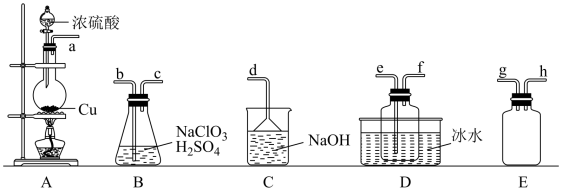
①装置A中反应的化学方程式为___________ 。
②装置B中反应的氧化剂与还原剂的物质的量之比为___________ 。
③欲收集一定量的ClO2,选择上图中的装置,其连接顺序为a→g→h→___________ →d。
(2)探究ClO2与Na2S的反应:
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。
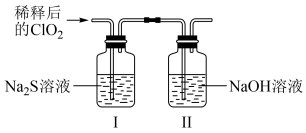
④ClO2与Na2S反应的离子方程式为___________ 。
已知:① ClO2是极易溶于水的黄绿色气体,有毒,沸点为11℃。
② SO2 + NaClO3 + H2SO4→ ClO2 + NaHSO4(未配平)。
③ ClO2 + NaOH→NaCl + NaClO3 + H2O(未配平)。
(1)设计如下装置制备ClO2:

①装置A中反应的化学方程式为
②装置B中反应的氧化剂与还原剂的物质的量之比为
③欲收集一定量的ClO2,选择上图中的装置,其连接顺序为a→g→h→
(2)探究ClO2与Na2S的反应:
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。

| 操作步骤 | 实验现象 | 结论 |
| 取少量Ⅰ中溶液放入试管甲中,滴加品红溶液和盐酸。 | 品红溶液始终不褪色 | ①无 |
| 另取少量Ⅰ中溶液放入试管乙中,加入Ba(OH)2溶液振荡。 | ② | 有SO 生成 生成 |
| ③继续在试管乙中加入Ba(OH)2溶液至过量,静置,取上层清液放入试管丙中, | 有白色沉淀生成 | 有Cl—生成 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装置:

(1)请写出过氧化钠与二氧化碳反应的化学方程式,并标明电子转移的方向和数目:_____________________________________ ;
(2)A中制取CO2的装置,应从下列图①、②、③中选哪个图:______ ;

(3)B装置的作用是___________________________________________ ;
(4)为了检验E中收集到的气体,在取出集气瓶后,用____ 的木条伸入集气瓶内,木条会出现____________________ ;
(5)若E中石灰水出现轻微白色浑浊,请说明原因:______________________ ;
(6)当D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
____________________________________________________________ ;
(7)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值____ (大或小),相差约_________ mL(取整数值,所用数据均在标准状况下测定),这是由于_______________________________________ ;

(1)请写出过氧化钠与二氧化碳反应的化学方程式,并标明电子转移的方向和数目:
(2)A中制取CO2的装置,应从下列图①、②、③中选哪个图:

(3)B装置的作用是
(4)为了检验E中收集到的气体,在取出集气瓶后,用
(5)若E中石灰水出现轻微白色浑浊,请说明原因:
(6)当D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
(7)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】资料显示:锌与浓硫酸共热除生成二氧化硫气体外,还可能产生氢气;在加热的条件下二氧化硫可被CuO氧化。为验证该反应的气体产物及性质,设计了如下图所示的实验装置(设锌与浓硫酸共热时产生的气体为X)。

(1)上述装置的连接顺序为:气体X→A→____ →A→ → → →D;
(2)反应开始后,观察到第一个装置A中的品红溶液褪色,实验结束后取适量该溶液于试管中并加热,现象为_______________________________________ ;
(3)装置 C中的NaOH溶液能用下列____ 代替;
a.酸性KMnO4溶液 b.CaCl2溶液 c.饱和NaHSO3溶液
装置D的作用是____________________________
(4)气体X中可能含有H2的原因是____________________________ 。

(1)上述装置的连接顺序为:气体X→A→
(2)反应开始后,观察到第一个装置A中的品红溶液褪色,实验结束后取适量该溶液于试管中并加热,现象为
(3)装置 C中的NaOH溶液能用下列
a.酸性KMnO4溶液 b.CaCl2溶液 c.饱和NaHSO3溶液
装置D的作用是
(4)气体X中可能含有H2的原因是
您最近一年使用:0次



