化学能与电能可以相互转化,工业生产中经常应用这些原理。
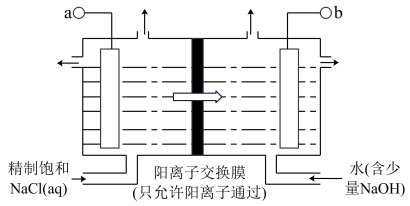
(1)利用氯碱厂生产的 作燃料,将氢燃料电站应用于氯碱工业,其示意图如下图所示。
作燃料,将氢燃料电站应用于氯碱工业,其示意图如下图所示。

①a极为___________ (填“正极”或“负极”)。
②乙装置中电解饱和NaCl溶液的化学方程式为___________ 。
③下列说法正确的是___________ 。
A.甲装置可以实现化学能向电能转化
B.甲装置中 透过阳离子交换膜向a极移动
透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④实际生产中,阳离子交膜的损伤会造成 迁移至阳极区,从而在
迁移至阳极区,从而在 中能检测到
中能检测到 ,下列生产措施有利于提高
,下列生产措施有利于提高 产量、降低阳极
产量、降低阳极 含量的是
含量的是___________ 。
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用 浓度高的精制饱和食盐水为原料
浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入 ,避免水电离的
,避免水电离的 直接得电子生成
直接得电子生成 ,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为___________ 。
(3)常温常压下电解合成氨的原理如图所示:

①阴极生成氨的电极反应式为___________ 。
②经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式___________ 。
(1)利用氯碱厂生产的
 作燃料,将氢燃料电站应用于氯碱工业,其示意图如下图所示。
作燃料,将氢燃料电站应用于氯碱工业,其示意图如下图所示。
①a极为
②乙装置中电解饱和NaCl溶液的化学方程式为
③下列说法正确的是
A.甲装置可以实现化学能向电能转化
B.甲装置中
 透过阳离子交换膜向a极移动
透过阳离子交换膜向a极移动C.乙装置中c极一侧流出的是淡盐水
④实际生产中,阳离子交膜的损伤会造成
 迁移至阳极区,从而在
迁移至阳极区,从而在 中能检测到
中能检测到 ,下列生产措施有利于提高
,下列生产措施有利于提高 产量、降低阳极
产量、降低阳极 含量的是
含量的是A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用
 浓度高的精制饱和食盐水为原料
浓度高的精制饱和食盐水为原料(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入
 ,避免水电离的
,避免水电离的 直接得电子生成
直接得电子生成 ,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为(3)常温常压下电解合成氨的原理如图所示:

①阴极生成氨的电极反应式为
②经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
更新时间:2024-01-01 20:28:08
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)等物质的量的氢气完全燃烧生成液态水与生成气态水相比,生成液态水时放出热量_______ (填“多”“少”或“相等”)。
(2)拆开1mol共价键所吸收的能量或形成1mol共价键所释放的能量称为键能。已知H-H键能为436kJ/mol,H─N键能为391kJ/mol,N≡N键能为946kJ/mol。根据键能计算工业合成氨时消耗1molN2能放出_______ kJ热量。
(3)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为_______ 。
(4)H2和O2组合形成的燃料电池的结构如图(电解液是稀硫酸):
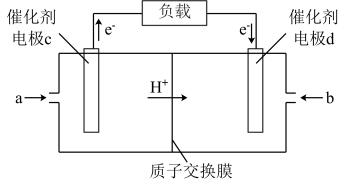
电极d的电极反应式为_______ 。
(5)氨氧燃料电池具有很大的发展潜力,其工作原理如图3所示。

a电极上的反应式为_______ 。
(6)高铁电池是一种新型可充电电池。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。已知负极反应式为Zn-2e-+2OH-=Zn(OH)2,则正极反应为
3Zn(OH)2+2Fe(OH)3+4KOH。已知负极反应式为Zn-2e-+2OH-=Zn(OH)2,则正极反应为_______ 。
(1)等物质的量的氢气完全燃烧生成液态水与生成气态水相比,生成液态水时放出热量
(2)拆开1mol共价键所吸收的能量或形成1mol共价键所释放的能量称为键能。已知H-H键能为436kJ/mol,H─N键能为391kJ/mol,N≡N键能为946kJ/mol。根据键能计算工业合成氨时消耗1molN2能放出
(3)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为
(4)H2和O2组合形成的燃料电池的结构如图(电解液是稀硫酸):

电极d的电极反应式为
(5)氨氧燃料电池具有很大的发展潜力,其工作原理如图3所示。

a电极上的反应式为
(6)高铁电池是一种新型可充电电池。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH。已知负极反应式为Zn-2e-+2OH-=Zn(OH)2,则正极反应为
3Zn(OH)2+2Fe(OH)3+4KOH。已知负极反应式为Zn-2e-+2OH-=Zn(OH)2,则正极反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题。
(1)恒温下,在体积为1L密闭容器中充入3molCO2(g)和9molH2(g),发生反应2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。___________ (填>、<或=)b点的逆反应速率。
②反应达到平衡状态时,CH3OCH3(g)的体积分数为___________ %(保留1位小数)。
③上述反应体系达到平衡状态的判断依据是___________ 。
A.容器内CO2和H2的物质的量之比不变
B.体系压强不变
C.容器内气体的密度不变
D.容器内气体的平均相对分子质量不变
(2)工业上合成氨气时需使用催化剂降低能耗,我国科学家提出使用M-LiH复合催化剂。相同条件下,不同催化剂的催化效果如图1所示,氨气的产率随时间变化如图2所示。350℃用Cr-LiH作催化剂对应的曲线是___________ (填“a”、“b”或“c”)___________ 。___________ 。
(1)恒温下,在体积为1L密闭容器中充入3molCO2(g)和9molH2(g),发生反应2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
②反应达到平衡状态时,CH3OCH3(g)的体积分数为
③上述反应体系达到平衡状态的判断依据是
A.容器内CO2和H2的物质的量之比不变
B.体系压强不变
C.容器内气体的密度不变
D.容器内气体的平均相对分子质量不变
(2)工业上合成氨气时需使用催化剂降低能耗,我国科学家提出使用M-LiH复合催化剂。相同条件下,不同催化剂的催化效果如图1所示,氨气的产率随时间变化如图2所示。350℃用Cr-LiH作催化剂对应的曲线是


您最近一年使用:0次
【推荐3】二氧化硫、二氧化氮、一氧化氮等污染物是大气背景监测重点。
(1)燃煤排放的尾气中含有二氧化硫、氮的氧化物(主要为NO)等污染物,工业上采用NaClO碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
①甲同学发现脱硫反应速率大于脱硝反应速率。原因除了SO2和NO在烟气中的初始浓度不同,还可能是_______ 。
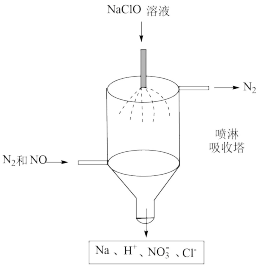
②乙同学设计了喷淋吸收塔装置(如图所示)进行脱硝。NaClO溶液吸收NO发生反应生成 的离子方程式为
的离子方程式为_______ ;该装置的优点是_______ 。
(2)某种利用垃圾渗透液实现发电装置示意图如图所示。
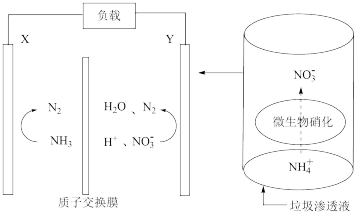
①Y电极上发生的反应为_______ 。
②当转移0.15mol电子时,生成标准状况下N2的体积为_______ 。
(3)已知下列反应的热化学方程式
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=-1036kJ·mol-1
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ΔH2=+94kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-484kJ·mol-1
计算H2S(g)热分解反应④2H2S(g)⇌S2(g)+2H2(g)的ΔH4=_______ 。
(4)在1070K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为_______ ,平衡常数Kp=_______ kPa。(结果保留3位有效数字,Kp是用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)
(1)燃煤排放的尾气中含有二氧化硫、氮的氧化物(主要为NO)等污染物,工业上采用NaClO碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
①甲同学发现脱硫反应速率大于脱硝反应速率。原因除了SO2和NO在烟气中的初始浓度不同,还可能是
②乙同学设计了喷淋吸收塔装置(如图所示)进行脱硝。NaClO溶液吸收NO发生反应生成
 的离子方程式为
的离子方程式为
(2)某种利用垃圾渗透液实现发电装置示意图如图所示。

①Y电极上发生的反应为
②当转移0.15mol电子时,生成标准状况下N2的体积为
(3)已知下列反应的热化学方程式
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=-1036kJ·mol-1
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ΔH2=+94kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-484kJ·mol-1
计算H2S(g)热分解反应④2H2S(g)⇌S2(g)+2H2(g)的ΔH4=
(4)在1070K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。
(1)如图所示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,'写出阳极产生ClO2的电极方程式:___ ;图中b电极为___ (填“阳极”或“阴极’”)。
(2)电解一段时间,当阴极产生标准状况下气体112mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为___ mol,阴极区pH___ (填“变大”“变小”或“不变”)。.
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(amol·L-1),现用ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:___ 。
(4)“84消毒液”是常用的消毒剂。电解氯化钠稀溶液也可制备“84消毒液”,若通电时氯气被溶液完全吸收,所得消毒液仅含一种溶质,写出相应的化学反应方程式:___ 。
(1)如图所示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,'写出阳极产生ClO2的电极方程式:

(2)电解一段时间,当阴极产生标准状况下气体112mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(amol·L-1),现用ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:
(4)“84消毒液”是常用的消毒剂。电解氯化钠稀溶液也可制备“84消毒液”,若通电时氯气被溶液完全吸收,所得消毒液仅含一种溶质,写出相应的化学反应方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:

(1)甲池是_________ 装置,通入O2气体的电极上的反应式为______________ 。乙池中SO42-移向_____ 电极(填“石墨”或“Ag”)。
(2) 当甲池消耗标况下33.6L O2时,电解质KOH的物质的量变化_____ mol,乙池若要恢复电解前的状态则需要加入__________ (填所加物质的质量及化学式)。
(3) 丙池中发生的电解反应的离子方程式为______________ 。

(1)甲池是
(2) 当甲池消耗标况下33.6L O2时,电解质KOH的物质的量变化
(3) 丙池中发生的电解反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5~4.5 ℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响。如何合理地利用CO2是摆在科学家面前的一个重大课题。回答下列问题:
(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为___ 。
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
写出该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式:___________________ 。
(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
则平衡时容器中甲烷的物质的量n(CH4)=________ 。从反应开始到达到平衡时的化学反应速率v(CH4)=__________ 。500 ℃时该反应的平衡常数K=16,则该反应的ΔH__________ (填“>”或“<”)0。
(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
①在容积为2 L的恒容密闭容器中,通入2 mol CO2和3 mol H2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__________ (填字母)。
a.消耗3 mol H2(g)时,有1 mol CH3OH(g)生成
b.转移3 mol电子时,反应的CO2为11.2 L(标准状况)
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3∶1
②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为______________________________ 。若将该燃料电池与电解饱和食盐水的装置进行串联(如图),当有0.12 mol 电子发生转移时,断开电源,将溶液冷却至室温,测得食盐溶液为120 mL,则此时乙装置中溶液的pH=________ (假设食盐水中有足量的NaCl,且Cl2完全逸出)。

(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
| CO2的量 | NaOH溶液的量 | 放出的热量 | |
| ① | 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
| ② | 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式:
(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:| 物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
| 浓度/mol·L-1 | 0.2 | 0.8 | a | 1.6 |
则平衡时容器中甲烷的物质的量n(CH4)=
(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。①在容积为2 L的恒容密闭容器中,通入2 mol CO2和3 mol H2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是
a.消耗3 mol H2(g)时,有1 mol CH3OH(g)生成
b.转移3 mol电子时,反应的CO2为11.2 L(标准状况)
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3∶1
②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为

您最近一年使用:0次



