化合物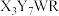 和
和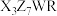 所含元素相同,相对分子质量
所含元素相同,相对分子质量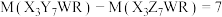 ,
,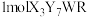 含
含 质子,X、W和R三种元素位于同周期,X原子最外层电子数是R原子核外电子数的一半,Y的原子符号为D。回答下列问题:
质子,X、W和R三种元素位于同周期,X原子最外层电子数是R原子核外电子数的一半,Y的原子符号为D。回答下列问题:
(1)元素R在周期表中的位置为_______ ,元素X的原子结构示意图为_______ ,元素W的元素符号为_______ 。
(2)Y和Z互为_______ ;比较元素W和R的原子半径:W_______ (填“<”或“>”)R。
(3)由元素Z和R可形成四核18电子的分子,写出该分子的电子式:_______ 。
(4)元素X、W和R简单氢化物的稳定性由高到低的顺序为_______ (用化学式表示)。
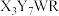 和
和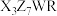 所含元素相同,相对分子质量
所含元素相同,相对分子质量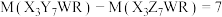 ,
,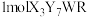 含
含 质子,X、W和R三种元素位于同周期,X原子最外层电子数是R原子核外电子数的一半,Y的原子符号为D。回答下列问题:
质子,X、W和R三种元素位于同周期,X原子最外层电子数是R原子核外电子数的一半,Y的原子符号为D。回答下列问题:(1)元素R在周期表中的位置为
(2)Y和Z互为
(3)由元素Z和R可形成四核18电子的分子,写出该分子的电子式:
(4)元素X、W和R简单氢化物的稳定性由高到低的顺序为
更新时间:2024-01-10 12:45:02
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E 同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为___________________ 。
(2)EAB2D4水溶液显酸性的原因是________________________________________ 。
(3)等浓度的EABD3和E2BD3混合溶液中,各离子的离子浓度由大到小的顺序为________________ 。
(4)A、B、D、E 四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2溶液反应的离子方程式____________________________________________ 。
(5)常温下,测得X 和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________ 。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2 (g ) ⇌ 2CA3(g) ΔH=-92.4 kJ·mol-1。反应达到平衡后,测得容器中各物质的物质的量分别为C2 0.5mol、A2 0.2mol、CA3 0.2 mol,此时容器体积为1.0 L。
①实验室制备CA3的的化学方程式____________________________ 。
②如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将__________ 移动(填“正向”、“逆向”或“不”)。
(1)BD2的电子式为
(2)EAB2D4水溶液显酸性的原因是
(3)等浓度的EABD3和E2BD3混合溶液中,各离子的离子浓度由大到小的顺序为
(4)A、B、D、E 四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2溶液反应的离子方程式
(5)常温下,测得X 和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2 (g ) ⇌ 2CA3(g) ΔH=-92.4 kJ·mol-1。反应达到平衡后,测得容器中各物质的物质的量分别为C2 0.5mol、A2 0.2mol、CA3 0.2 mol,此时容器体积为1.0 L。
①实验室制备CA3的的化学方程式
②如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将
您最近半年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐2】A、 B、C、D、E、F、G为原子序数依次增大的前四周期元素。A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级。且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对。E与F同周期;G的原子序数等于A、C、D、F四种元素原子序数之和。
(1)写出B的基态原子的核外电子排布图________ ;回答E与F原子的第一电离能的大小关系怎样 ______________ 。原因是_____________________________________ ;
(2)C3-是一种弱酸根离子,请写出两种与C3-互为等电子体的分子的化学式_______ ,________ ;
(3)A与D形成的A2D2分子中D原子的杂化类型为_________ 杂化,A与C形成的最简单分子易溶于水的原因____________________________ ;
(4)G的晶体中原子按_________ (填“ABABAB”或“ABCABCABC”)的方式堆积而成,G的晶体堆积模型名称______________________ ;
(5) G的晶体中G原子的配位数为_________ ,空间利用率为__________________ ;
(6)元素G的一种氯化物的晶胞如图所示,该氯化物的化学式,两种微粒间最短距离为460.0 pm,晶体密度为________ g/cm3。(列式表示)
 .
.
(1)写出B的基态原子的核外电子排布图
(2)C3-是一种弱酸根离子,请写出两种与C3-互为等电子体的分子的化学式
(3)A与D形成的A2D2分子中D原子的杂化类型为
(4)G的晶体中原子按
(5) G的晶体中G原子的配位数为
(6)元素G的一种氯化物的晶胞如图所示,该氯化物的化学式,两种微粒间最短距离为460.0 pm,晶体密度为
 .
.
您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】A、B、C、D为原子序数依次增大的四种元素,简单离子A2-和D+相差一个电子层,B、C为同周期元素,B原子核外电子总数是最外层电子数的3倍,C元素的原子最外层有一个未成对电子。请回答下列问题:
(1)基态B原子的核外电子排布式为___ 。
(2)A有两种同素异形体,其中沸点最高的是___ ,原因是___ 。
(3)B、C可组成原子个数比为1:3的化合物E,其电子式为___ ,E溶于水有白雾生成,写出它与水反应的化学方程式___ 。
(4)化合物C2A的立体构型为___ ,中心原子的价电子对数为___ ,用单质C与湿润的Na2CO3溶液反应可制得C2A,其反应方程式为___ 。
(5)A和D能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.60nm,F的化学式为___ ,晶胞中A原子的配位数为___ ,列式计算晶体F的密度___ (g·cm-3)。

(1)基态B原子的核外电子排布式为
(2)A有两种同素异形体,其中沸点最高的是
(3)B、C可组成原子个数比为1:3的化合物E,其电子式为
(4)化合物C2A的立体构型为
(5)A和D能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.60nm,F的化学式为

您最近半年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】某研究小组为了探究化合物X的组成,设计并完成了如图实验:

已知:①化合物X由三种短周期元素(均不同主族)组成,且阴、阳离子个数之比为2:1;
②气体A为非金属气体单质,单质D常用来制作信号弹和烟火;
③金属化合物C是仅由两种相邻且同周期的金属元素组成的。
请回答下列问题:
(1)白色胶状沉淀F为___________ (填化学式),金属化合物C的组成为___________ (写最简比)。
(2)化合物X的一价阴离子与CH4具有相同的空间结构,写出该阴离子的电子式:___________ 。
(3)③中通入过量CO2的目的是___________ 。
(4)气体A与单质D制备化合物H的过程中,通常产品中会夹杂单质D。有同学设计了如图所示的实验装置,检验mg产品中单质D的含量。
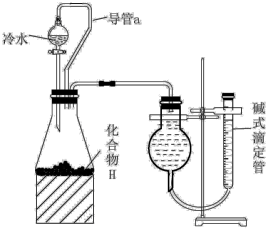
①写出化合物H与冷水反应的化学方程式:___________ 。
②装置中导管a的作用是___________ 。
③设该状态下的气体的摩尔体积为VmL·mol-1,实验前后碱式滴定管中液面读数分别为V1mL、V2mL。则产品中单质D的含量为___________ (用含m、Vm、V1、V2的代数式表示,忽略单质D与冰水的反应)。

已知:①化合物X由三种短周期元素(均不同主族)组成,且阴、阳离子个数之比为2:1;
②气体A为非金属气体单质,单质D常用来制作信号弹和烟火;
③金属化合物C是仅由两种相邻且同周期的金属元素组成的。
请回答下列问题:
(1)白色胶状沉淀F为
(2)化合物X的一价阴离子与CH4具有相同的空间结构,写出该阴离子的电子式:
(3)③中通入过量CO2的目的是
(4)气体A与单质D制备化合物H的过程中,通常产品中会夹杂单质D。有同学设计了如图所示的实验装置,检验mg产品中单质D的含量。

①写出化合物H与冷水反应的化学方程式:
②装置中导管a的作用是
③设该状态下的气体的摩尔体积为VmL·mol-1,实验前后碱式滴定管中液面读数分别为V1mL、V2mL。则产品中单质D的含量为
您最近半年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐2】A、B、C、D、E、F为短周期元素,非金属元素 最外层电子数与其周期数相同,
最外层电子数与其周期数相同, 的最外层电子数是其所在周期数的2倍。
的最外层电子数是其所在周期数的2倍。 在D中充分燃烧能生成其最高价化合物
在D中充分燃烧能生成其最高价化合物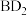 。
。 与
与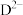 具有相同的电子数。
具有相同的电子数。 在
在 中燃烧,产物溶于水得到一种强酸。回答下列问题:
中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)写出一种实验室制备单质 的化学方程式
的化学方程式_______ 。
(2)B、D、E组成的一种盐中, 的质量分数为
的质量分数为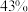 ,其俗名为
,其俗名为_______ ,其水溶液与少量 单质反应的化学方程式为
单质反应的化学方程式为_______ 。
(3)由这些元素组成的物质,其组成和结构信息如下表:
 的化学为
的化学为_______ ; 的化学式为
的化学式为_______  的电子式为
的电子式为_______ 。
(4)由A和B、D元素组成的两种二元化合物(含有两种不同元素)形成一类新能源物质。一种化合物分子通过_______ 构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为_______ 。
 最外层电子数与其周期数相同,
最外层电子数与其周期数相同, 的最外层电子数是其所在周期数的2倍。
的最外层电子数是其所在周期数的2倍。 在D中充分燃烧能生成其最高价化合物
在D中充分燃烧能生成其最高价化合物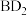 。
。 与
与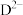 具有相同的电子数。
具有相同的电子数。 在
在 中燃烧,产物溶于水得到一种强酸。回答下列问题:
中燃烧,产物溶于水得到一种强酸。回答下列问题:(1)写出一种实验室制备单质
 的化学方程式
的化学方程式(2)B、D、E组成的一种盐中,
 的质量分数为
的质量分数为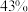 ,其俗名为
,其俗名为 单质反应的化学方程式为
单质反应的化学方程式为(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物 | 组成和结构信息 |
| a | 含有 的由两种元素形成的离子化合物 的由两种元素形成的离子化合物 |
| b | 含有非极性共价键的由两种元素形成的离子化合物,且原子数之比为 |
| c | 化学组成为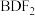 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 的化学为
的化学为 的化学式为
的化学式为 的电子式为
的电子式为(4)由A和B、D元素组成的两种二元化合物(含有两种不同元素)形成一类新能源物质。一种化合物分子通过
您最近半年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】有M、V、W、X、Y、Z六种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z是金属元素;M元素的一种核素原子核内无中子,Z元素原子的最外层只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。V的单质在空气中含量最高。回答下列问题:
(1)M的一种核素中质子数为中子数的 ,则该核素的名称为
,则该核素的名称为__ 。
(2)Z的元素符号为__ 。
(3)X元素的单质与Z的最高价氧化物对应的水化物反应的离子反应方程式为__ 。
(4)Y的单质在加热条件下与铁反应的化学方程式为__ 。
(5)非金属性W__ Y(填大于或小于)
(6)用一个方程式证明W和Y的非金属性强弱__ 。
(7)实验室中,V的最高价氧化物对应的水化物可用Y的最高价氧化物对应的水化物制得,写出相应的化学反应方程式___ 。
(1)M的一种核素中质子数为中子数的
 ,则该核素的名称为
,则该核素的名称为(2)Z的元素符号为
(3)X元素的单质与Z的最高价氧化物对应的水化物反应的离子反应方程式为
(4)Y的单质在加热条件下与铁反应的化学方程式为
(5)非金属性W
(6)用一个方程式证明W和Y的非金属性强弱
(7)实验室中,V的最高价氧化物对应的水化物可用Y的最高价氧化物对应的水化物制得,写出相应的化学反应方程式
您最近半年使用:0次



