硫代硫酸钠 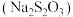 在工业生产、医药制造业中被广泛应用,工业普遍使用
在工业生产、医药制造业中被广泛应用,工业普遍使用 与硫黄
与硫黄 共煮得到。
共煮得到。
(1)除了以上原料可以制备 ,根据“价-类”二维图信息分析,还有合理的是___________。
,根据“价-类”二维图信息分析,还有合理的是___________。
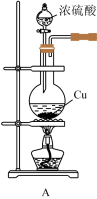
(2)如图:向圆底烧瓶中加入浓硫酸并加热,烧瓶中反应的化学方程式:___________ ;过程主要表现了浓硫酸的哪些性质___________ 。
(3)直到反应完毕,最后发现烧瓶中还有一定量的 和
和 剩余,问题讨论:为什么有一定量的余酸还未能使
剩余,问题讨论:为什么有一定量的余酸还未能使 完全溶解。你认为原因是
完全溶解。你认为原因是___________ ,足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是___________ ,___________ 。(填两类不同的化学物质)
A.Fe B.BaCl2溶液 C.Ag D.Na2CO3溶液
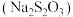 在工业生产、医药制造业中被广泛应用,工业普遍使用
在工业生产、医药制造业中被广泛应用,工业普遍使用 与硫黄
与硫黄 共煮得到。
共煮得到。(1)除了以上原料可以制备
 ,根据“价-类”二维图信息分析,还有合理的是___________。
,根据“价-类”二维图信息分析,还有合理的是___________。A. | B.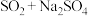 | C. | D.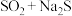 |
(2)如图:向圆底烧瓶中加入浓硫酸并加热,烧瓶中反应的化学方程式:
(3)直到反应完毕,最后发现烧瓶中还有一定量的
 和
和 剩余,问题讨论:为什么有一定量的余酸还未能使
剩余,问题讨论:为什么有一定量的余酸还未能使 完全溶解。你认为原因是
完全溶解。你认为原因是A.Fe B.BaCl2溶液 C.Ag D.Na2CO3溶液
更新时间:2024-04-29 19:00:45
|
相似题推荐
【推荐1】回答下列问题:
(1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生___________ 反应,说明亚硝酸钠具有___________ 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有___________ 性。
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=CeF3+16NH3↑+12H2O+N2↑,该反应中还原剂是___________ ,反应中被氧化的氮原子与未被氧化的氮原子个数比为___________ 。
(3)过氧化氢溶液可作为采矿业废液消毒剂,如消除废液中剧毒的氰化钾(KCN,其中氮元素为-3价),反应方程式为KCN+H2O2+H2O=A+NH3↑(已配平)。
①该反应是否属于氧化还原反应?___________ (填“是”或“否”),理由是___________ 。若是,则被还原的元素是___________ 。
②生成物A的化学式是___________ 。
③该反应中发生氧化反应的物质是___________ ,理由是___________ 。
④若生成4个NH3分子,转移电子数为___________ 。
⑤用双线桥法表示反应中电子转移的方向和数目:___________ 。
(1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=CeF3+16NH3↑+12H2O+N2↑,该反应中还原剂是
(3)过氧化氢溶液可作为采矿业废液消毒剂,如消除废液中剧毒的氰化钾(KCN,其中氮元素为-3价),反应方程式为KCN+H2O2+H2O=A+NH3↑(已配平)。
①该反应是否属于氧化还原反应?
②生成物A的化学式是
③该反应中发生氧化反应的物质是
④若生成4个NH3分子,转移电子数为
⑤用双线桥法表示反应中电子转移的方向和数目:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是________ 。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NaCN属于剧毒物质,有多种无害化处理方法。
① H2O2处理法:NaCN+H2O2→N2↑+X+H2O推测X的化学式为________ 。
② NaClO处理法:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O方程式中e∶f的值为________ (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
(3)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液混合液共200 mL(设其中CN-的浓度为0.2 mol·L-1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:___________________________ ;
②若结果测得CO2的质量为1.408 g,则该实验中测得CN-被处理的百分率为_____________ 。
(1)钠、钾着火,下列可用来灭火的是
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NaCN属于剧毒物质,有多种无害化处理方法。
① H2O2处理法:NaCN+H2O2→N2↑+X+H2O推测X的化学式为
② NaClO处理法:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O方程式中e∶f的值为
A.1 B.1/2 C.2 D.不能确定
(3)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液混合液共200 mL(设其中CN-的浓度为0.2 mol·L-1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:
②若结果测得CO2的质量为1.408 g,则该实验中测得CN-被处理的百分率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
)是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 ,
,

(1)除了用二氧化锰和浓盐酸反应外,实验室可以用氯酸钾和浓盐酸反应制取氯气,反应方程式如下: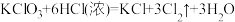 。
。
①浓盐酸在反应中显示出来的性质是___________ 。
②若产生标况下 ,则被氧化的HCl的物质的量为
,则被氧化的HCl的物质的量为___________ mol。
③如果要将装置B补充完整,除需用导管外,试剂瓶中还应装的除杂试剂为___________ 。
(2)C中得到紫色固体和溶液。C中 发生的反应有
发生的反应有 。另外还有
。另外还有______ 。(用离子方程式表示)
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是___________ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为2%,则生产1000kg该溶液需消耗氯气的质量为___________ kg(保留整数)。
 )是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
)是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 ,
,
(1)除了用二氧化锰和浓盐酸反应外,实验室可以用氯酸钾和浓盐酸反应制取氯气,反应方程式如下:
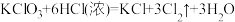 。
。①浓盐酸在反应中显示出来的性质是
②若产生标况下
 ,则被氧化的HCl的物质的量为
,则被氧化的HCl的物质的量为③如果要将装置B补充完整,除需用导管外,试剂瓶中还应装的除杂试剂为
(2)C中得到紫色固体和溶液。C中
 发生的反应有
发生的反应有 。另外还有
。另外还有(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】实验室制取下列气体时,应选用下列哪种酸:
A.浓盐酸B.稀盐酸 C.稀硫酸D.浓硫酸
用大理石和___________ 制 CO2;用食盐和___________ 制HCl。
A.浓盐酸B.稀盐酸 C.稀硫酸D.浓硫酸
用大理石和
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】硫酸是中学化学实验室的常见药品,其性质有①酸性 ②吸水性 ③脱水性 ④强氧化性,请将序号填在相应的横线上:
(1)锌和稀H2SO4制H2________ ;
(2)浓硫酸作干燥剂________ ;
(3)浓硫酸使蔗糖炭化并产生刺激性气味气体________ ;
(4)浓硫酸与铜的反应________ ;(5)浓硫酸使硫酸铜晶体变白________ ;
(6)浓硫酸使湿润的蓝色石蕊试纸先变红,后来又变黑________ 。
(1)锌和稀H2SO4制H2
(2)浓硫酸作干燥剂
(3)浓硫酸使蔗糖炭化并产生刺激性气味气体
(4)浓硫酸与铜的反应
(6)浓硫酸使湿润的蓝色石蕊试纸先变红,后来又变黑
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。下列各项分别表现浓硫酸的什么性质,请将序号填于空白处:
(1)浓硫酸与食盐共热,浓硫酸表现的性质为__ 。
(2)浓硫酸与铜共热,化学方程式为__ ,浓硫酸表现的性质是__ 。
(3)浓硫酸与红热木炭反应,化学方程式为__ ,浓硫酸表现的性质是__ 。
(4)可用浓硫酸干燥H2、CO2、HCl等气体,浓硫酸表现的性质为__ 。
(5)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,浓硫酸表现的性质是__ 。
(1)浓硫酸与食盐共热,浓硫酸表现的性质为
(2)浓硫酸与铜共热,化学方程式为
(3)浓硫酸与红热木炭反应,化学方程式为
(4)可用浓硫酸干燥H2、CO2、HCl等气体,浓硫酸表现的性质为
(5)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,浓硫酸表现的性质是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】按要求完成下列填空:
(1)胆矾的化学式:_______ ;生石灰的化学式:_______ ;写出H2O的空间构型:_______ 。
(2)覆铜板制作印刷电路板原理的离子方程式:_______ 。
(3)炭和浓硫酸反应的化学方程式:_______ 。
(4)相同条件下,冰的密度比水小的原因是_______ 。
(1)胆矾的化学式:
(2)覆铜板制作印刷电路板原理的离子方程式:
(3)炭和浓硫酸反应的化学方程式:
(4)相同条件下,冰的密度比水小的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】硫酸是三大工业用酸之一,在冶金、石油工业、制药、国防等方面都要用到硫酸。将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。试回答:
(1)加入少量水的原因是_________________________________________________ 。
(2)生成的黑色物质是______________ (写出化学式)。
(3)“体积膨胀,并放出有刺激性气味的气体(SO2)”,写出对应的化学方程式:_________________________________________________ 。
(4)上述现象体现了浓硫酸的_________________ (填序号)
①酸性 ②吸水性 ③脱水性 ④强氧化性
(5)向80mL浓硫酸中加入5.6g铜,加热一段时间后至不再反应为止,实验测得反应中共有1.12L(标准状况下)SO2气体生成,该反应的化学方程式为_____________________________________ ,反应中转移电子______ mol,铜剩余_______ g,该反应中浓硫酸体现了___________ 和__________ 。
(1)加入少量水的原因是
(2)生成的黑色物质是
(3)“体积膨胀,并放出有刺激性气味的气体(SO2)”,写出对应的化学方程式:
(4)上述现象体现了浓硫酸的
①酸性 ②吸水性 ③脱水性 ④强氧化性
(5)向80mL浓硫酸中加入5.6g铜,加热一段时间后至不再反应为止,实验测得反应中共有1.12L(标准状况下)SO2气体生成,该反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)利用如图装置除去下列气体中的杂质气体,若要除去NO中混有的少量NO2,洗气瓶中应装_______ ;化学方程式为_______ 。若要除去SO2中混有的少量SO3气体,洗气瓶中装试剂为:_______ ,化学方程式为_______ 。
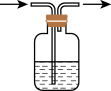
(2)加热的浓硫酸与木炭反应:_______ 。其中氧化剂是_______ (写化学式),还原产物是_______ (写化学式)。
(3)稀硝酸与铜片的反应:_______ ,若有2molHNO3被还原,则有_______ mol电子转移。
(4)请用方程式解释为什么盛装烧碱溶液试剂瓶的塞子不能用玻璃塞:_______ 写出用HF雕刻玻璃时发生的化学反应方程式_______

(2)加热的浓硫酸与木炭反应:
(3)稀硝酸与铜片的反应:
(4)请用方程式解释为什么盛装烧碱溶液试剂瓶的塞子不能用玻璃塞:
您最近一年使用:0次



