(1)有机物M经过太阳光光照可转化成N,转化过程如图:
 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1;②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1;③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1;CH4、H2组成的混合气体2mol,完全㜔烧后放出热量1297.0kJ能量,该混合气体中CH4与H2的物质的量之比n(CH4):n(H2)=
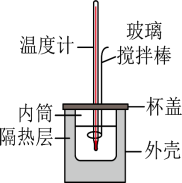
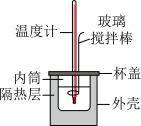
(二)0.50mol•L-1的盐酸与0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
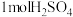 溶于不同量水中的热效度如下表:
溶于不同量水中的热效度如下表: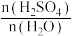 | 2.0 | 1.0 | 0.67 | 0.50 | 0.33 |  |
溶解放热 | 15.8 | 27.8 | 35.9 | 41.6 | 48.9 | 95.3 |
A.当
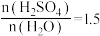 时,溶解放热
时,溶解放热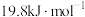
B.向
 的溶液中加入9g水,放出热量6.9kJ
的溶液中加入9g水,放出热量6.9kJC.用
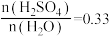 的溶液测定中和反应的反应热会使△H偏小
的溶液测定中和反应的反应热会使△H偏小(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t1-t2)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | 2.5 |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | 4 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 |
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=
(6)下列说法正确的是
a.为了使反应充分进行,药品可以分多次加入
b.完成一次中和反应反应热平行样的测定,温度计需要使用2次
c.测量NaOH与不同种类的酸(如HCl、
 等)中和反应的反应热,数值可能不同
等)中和反应的反应热,数值可能不同d.用温度计测定NaOH溶液起始温度后直接测定
 溶液的温度
溶液的温度
相似题推荐
 的
的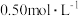 盐酸与
盐酸与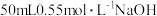 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
I II III
请回答下列问题:
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、量筒、
(2)用醋酸代替盐酸溶液进行上述实验,测得的中和热的数值会
(3)若在实验过程中,不把温度计上的酸用水冲洗干净直接测量
 溶液的温度,则测得的
溶液的温度,则测得的
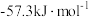 。为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容。则:①
。为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容。则:①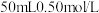 盐酸的质量
盐酸的质量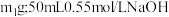 溶液的质量
溶液的质量 ;②两溶液混合后的溶液的比热容为
;②两溶液混合后的溶液的比热容为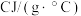 ,反应前后溶液的温度差为
,反应前后溶液的温度差为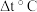 ;根据温度差和比热容等计算中和热的数值为:
;根据温度差和比热容等计算中和热的数值为: .
.(4)工业上可通过天然气跟水蒸气反应制取
 ,有关反应的能量变化如图所示,则该反应的
,有关反应的能量变化如图所示,则该反应的
 (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(1)有机物M经过太阳光光照可转化成N,转化过程如图:
 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1则M、N相比,较稳定的是
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1;
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1;
③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1;
CH4、H2组成的混合气体2mol,完全㜔烧后放出热量1297.0kJ能量,该混合气体中CH4与H2的物质的量之比n(CH4):n(H2)=
(二)0.50mol•L-1的盐酸与0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
(4)实验中若改用60mL0.50mol•L-1的盐酸与50mL0.55mol•L-1的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t1-t2)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1。则中和热△H=
(6)下列说法正确的是
a.向内筒中加入稀盐酸时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸如入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1molH2O(l)时所测得的中和反应的反应热(△H)有影响,△H会偏大
(1)一氧化碳催化加氢制甲醇,反应原理为:

 。
。①若已知CO、
 、
、 的燃烧热分别为
的燃烧热分别为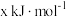 、
、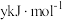 、
、 ,则
,则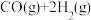


②已知反应中相关的化学键键能数据如下:
| 化学键 |  |  | 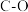 | 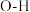 |
 | 436 | 413 | 343 | 465 |
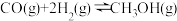
 ,试计算断开
,试计算断开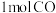 气体中的
气体中的 需提供的最低能量为
需提供的最低能量为(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,其常用单位为
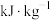 。已知下列物质的燃烧热(25℃、
。已知下列物质的燃烧热(25℃、 ):
):| 燃料 |  |  |  | 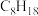 (辛烷) (辛烷) |
燃烧热/( ) ) | 285.8 | 283.0 | 890.3 | 5518 |
①试写出表示辛烷燃烧热的热化学方程式
②
 的热值为
的热值为③上表所列燃料的热值最大的是
(3)中和热是反应热的一种。
①取
 溶液和
溶液和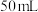 盐酸进行实验,若实验测得的反应前后温度差平均值
盐酸进行实验,若实验测得的反应前后温度差平均值 ,中和后生成溶液的比热容
,中和后生成溶液的比热容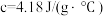 (若近似认为
(若近似认为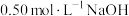 溶液和
溶液和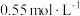 盐酸的密度都是
盐酸的密度都是 )。则生成
)。则生成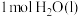 时的反应热
时的反应热
②强酸与强碱的稀溶液发生中和反应生成
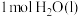 时的反应热
时的反应热 。若用一定浓度的稀硫酸与含
。若用一定浓度的稀硫酸与含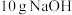 的稀碱溶液完全反应,反应放出的热量为
的稀碱溶液完全反应,反应放出的热量为(1)有机物M经过太阳光光照可转化成N,转化过程如图:
 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1则M、N相比,较稳定的是
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1;
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1;
③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1;
CH4、H2组成的混合气体2mol,完全㜔烧后放出热量1297.0kJ能量,该混合气体中CH4与H2的物质的量之比n(CH4):n(H2)=
(二)0.50mol•L-1的盐酸与0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:

(4)实验中若改用60mL0.50mol•L-1的盐酸与50mL0.55mol•L-1的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t1-t2)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1。则中和热△H=
(6)下列说法正确的是
a.向内筒中加入稀盐酸时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸如入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1molH2O(l)时所测得的中和反应的反应热(△H)有影响,△H会偏大
 的
的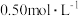 盐酸与
盐酸与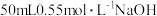 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
I II III
请回答下列问题:
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、量筒、
(2)用醋酸代替盐酸溶液进行上述实验,测得的中和热的数值会
(3)若在实验过程中,不把温度计上的酸用水冲洗干净直接测量
 溶液的温度,则测得的
溶液的温度,则测得的
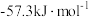 。为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容。则:①
。为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容。则:①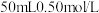 盐酸的质量
盐酸的质量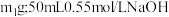 溶液的质量
溶液的质量 ;②两溶液混合后的溶液的比热容为
;②两溶液混合后的溶液的比热容为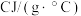 ,反应前后溶液的温度差为
,反应前后溶液的温度差为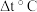 ;根据温度差和比热容等计算中和热的数值为:
;根据温度差和比热容等计算中和热的数值为: .
.(4)工业上可通过天然气跟水蒸气反应制取
 ,有关反应的能量变化如图所示,则该反应的
,有关反应的能量变化如图所示,则该反应的
 (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(1)已知相关热化学方程式为:
4Al(s)+3O2(g)=2Al2O2(s) △H1=a kJ•mol﹣1
3MnO2(s)=Mn3O4(s)+O2(g) △H2=bkJ•mol﹣1
3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) △H3=ckJ•mol﹣1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) △H=
(2)MnCO3广泛用作锰盐原料.通过如图装置焙烧MnCO3可以制取MnO2,反应方程式为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)。
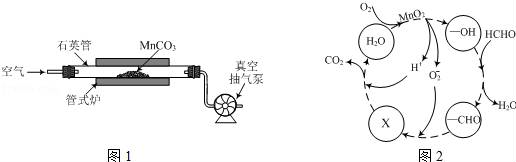
①2MnCO3(s)+O2(g)⇌2MnO2(s)+2CO2(g)的化学平衡常数表达式K=
②用真空抽气泵不断抽气的目的除保证反应持续进行外,还有
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是

(3)MnO2常用作催化剂。MnO2催化降解甲醛的反应机理如图所示,图中X表示的粒子是
(4)MnSO4是重要微量元素肥料。用惰性电极电解MnSO4溶液可以制得更好活性的MnO2,电解时总反应的离子方程式为:
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)∆H1=-49.1kJ/mol
CH3OH(g)+H2O(g)∆H1=-49.1kJ/mol反应II:CH3OCH3(g)+H2O(g)
 2CH3OH(g)∆H2=+24.5kJ/mol
2CH3OH(g)∆H2=+24.5kJ/mol反应III:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)∆H3
CH3OCH3(g)+3H2O(g)∆H3(1)∆H3=
(2)在绝热恒容的密闭容器中,将CO2和H2按物质的量之比1:3投料发生反应I,下列能说明反应已达平衡的是
A.体系的温度保持不变
B.CO2和H2的转化率相等
C.单位时间内体系中3molH2减少的同时1molH2O增加
D.合成CH3OH的反应限度达到最大
(3)已知:反应II在某温度下的平衡常数的值为2,在此温度下向密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g)发生该反应,某时刻测得CH3OCH3、H2O、CH3OH的浓度依次为1.5mol/L、1.5mol/L、1mol/L,此时CH3OCH3的转化率是
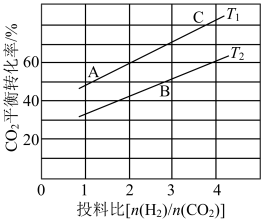
(4)在某压强下,反应I在不同温度、不同投料比时CO2的平衡转化率如图所示。则温度Tl
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和III,在相同的时间段内CH3OH的产率、选择性随温度的变化如图所示。其中CH3OH的选择性=
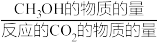 ×100%
×100%
①当温度高于230°C时,CH3OH产率下降的可能原因是
②在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.CZT催化剂 D.CZ(Zr-1)T催化剂

 ①
①
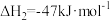 ②
②Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)
 ③
③写出
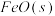 被CO还原成Fe和
被CO还原成Fe和 的热化学方程式
的热化学方程式(2)直接氨硼烷
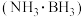 电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为
电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为 。已知两极室中电解质足量,则正极的电极反应为
。已知两极室中电解质足量,则正极的电极反应为
(3)
 是绿色硝化试剂,溶于水可得硝酸,下图是以N2O4为原料电解制备N2O5的装置,写出阳极区生成N2O5的电极反应为
是绿色硝化试剂,溶于水可得硝酸,下图是以N2O4为原料电解制备N2O5的装置,写出阳极区生成N2O5的电极反应为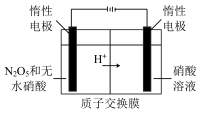
(4)1.52g铜镁合金完全溶解于50mL密度为
 、质量分数为63%的浓硝酸中,得到
、质量分数为63%的浓硝酸中,得到 和
和 的混合气体1120mL(标准状况),向反应后的溶液中加入
的混合气体1120mL(标准状况),向反应后的溶液中加入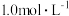 NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,加入的NaOH溶液体积
NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,加入的NaOH溶液体积


